Трихофития собак | ГБУ РО Рязанская областная ветеринарная лаборатория г.Рязань
5 февраля 2018 года в отдел физико-химических и радиологических исследований ГБУ РО «Рязанская областная ветеринарная лаборатория» был доставлен патологический материал от собаки (шерсть), для проведения исследования на дерматофиты.
При микологическом исследовании, отделом физико-химических и радиологических исследований в патологическом материале от собаки обнаружены споры грибов рода Trichophyton. Диагноз трихофития установлен.
Трихофития (стригущий лишай) – это кожное инфекционное заболевание, развитие которой вызывают споры патогенных грибков. Заболевание опасно не только для питомцев, но и для их владельцев.
Возбудителями трихофитии являются грибки, которые относятся к роду Trichophyton. Их споры могут быть где угодно: на подстилке, в почве, на коже зараженного животного, в навозе и т.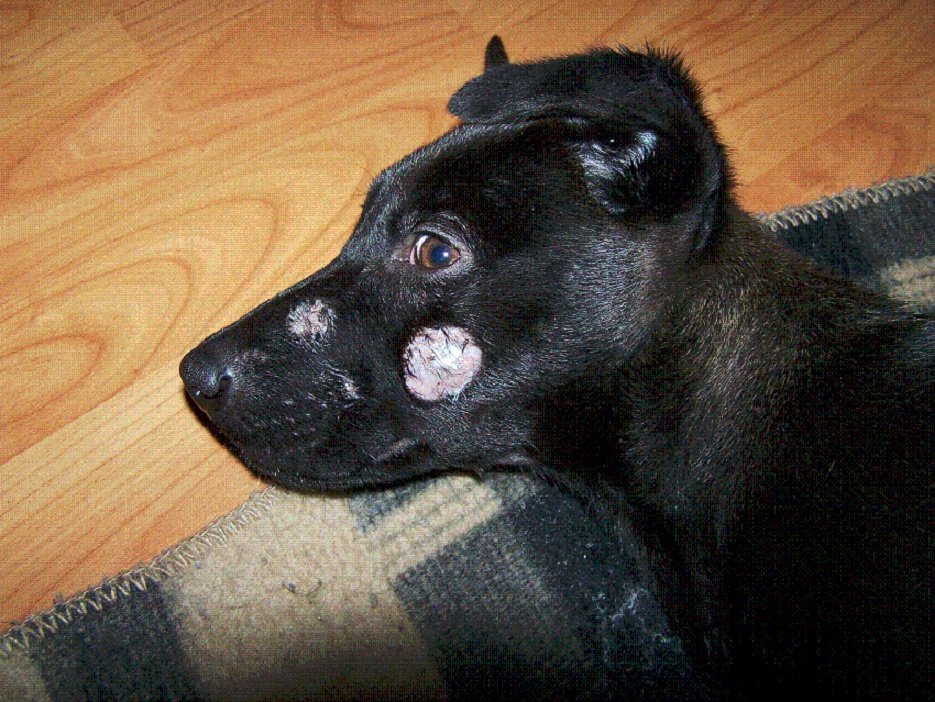
К благоприятным факторам разбития заболевания относят:
- наличие на коже царапин и ранок;
- ослабленный иммунитет;
- отсутствие полноценного питания;
- наличие паразитарных заболеваний;
- наличие кожных болезней.
Организм таких собак не может сопротивляться развитию грибка, так как находится в сильно ослабленном состоянии. Именно их заболевание поражает в первую очередь.
Симптомы трихофитии у собак
Стоит отметить, что во время инкубационного периода хозяева даже не догадываются о наличии у питомца заболевания, так как яркие признаки в этот момент отсутствуют. Но уже спустя приблизительно две недели симптоматика проявляется очень чётко.
Возбудитель начинает размножаться в эпидермисе и шерсти собаки. Грибки разрушают волосяные луковицы и выделяют токсичные вещества, которые приводят к воспалению и разрыхлению верхних слоев кожи.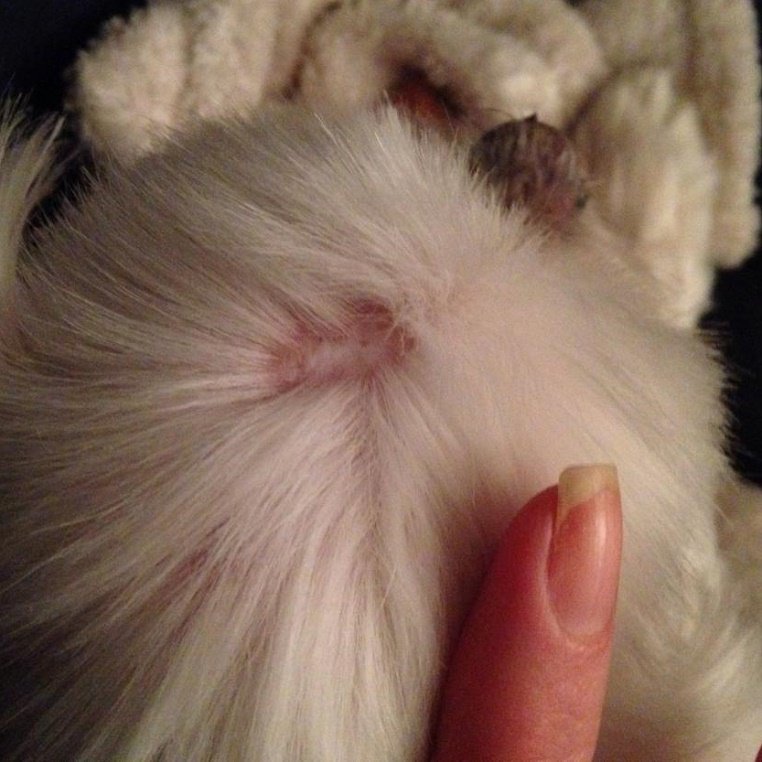
Лечение назначает ветеринарный врач. При появлении первых симптомов заболевания, следует отвести животное в ветеринарную клинику.
Меры профилактики:
Элементарные правила способствуют если не полной защите животного от заболевания, то значительному снижению рисков инфицирования:
- необходимо проводить в доме, где живёт питомец, ежедневную влажную уборку. При этом использовать дезинфицирующие средства;
- мыть лапы животного после каждой прогулки и купать его по мере необходимости;
- помнить, что заболевание передаётся контактным путём, и избегать бродячих собак;
- своевременно избавлять питомца от паразитов;
- собака должна жить в соответствующих гигиенических условиях;
- обеспечить правильное и полноценное питание домашнему любимцу.

Отдельное внимание стоит уделить специальной противоинфекционной вакцине. Она может использоваться как для лечения заболевания, так и в качестве профилактического средства.
Трихофития у животных — лечение, диагностика
Название «лишай» (Lichen) известно со времен Гиппократа, под ним объединены многие заболевания кожи, для которых характерно образование цветных пятен и шелушение.
Стригущий лишай (трихофития) – заразное грибковое заболевание, опасное тем, что им могут заразиться и люди.
Грибок поражает верхние слои кожи, ногти (когти) и волосяную луковицу, вызывая выпадение волоса.
Клинические признаки:
- Сначала появляется сыпь на коже, которую часто можно не увидеть под длинной и густой шерстью.
- Потом на коже может появляются шелушения, пораженные волосы «линяют» очень активно и большими пучками, образуя объемные очаги облысения.
- Зуд при лишае (трихофитии) – бывает далеко не всегда.

- Область поражения любая — лапы, голова, тело, подушечки лап.
- При глубоком поражении кожи возможно появление эрозий-язвочек.
Диагностика трихофитии
Для диагностики заболевания применяют следующие методы:
- Люминесцентная диагностика – при трихофитии свечения под лампой Вуда не будет.
- Трихоскопия – осмотр волос с пораженных и ярдом участков под микроскопом, на предмет выявления спор грибов, иногда возможно окрашивание волос специальной краской, но краска эта редкая и довольно дорогая.
- Посев на дерматофитозы. Волосы с пораженных участков высевают на специальных питательных средах, для точного подтверждения диагноза. Этот метод наиболее достоверный и точный при стригущем лишае.
Лечение трихофитии
Лечение вашему животному подбирает ветеринарный врач в ветеринарной клинике.
Лечение кошек и собак обычно сводится к применению 2 типов препаратов:
- системные противогрибковые
- наружные обработки специальными антисептиками.

Обязательна изоляция животного.
Лечение может занимать до нескольких недель-месяцев, особенно у ослабленных животных, до полного избавления от трихофитии.
В наших ветеринарных клиниках на Васильевском острове и Парнасе вам всегда проведут максимально возможную диагностику и подберут соответствующее лечение при поражении животного дерматофитозами.
Лечение грибка трихофитии у кошек: признаки
Абсцесс у кошек, собакАбсцесс – это ограниченный участок нагноения, который приводит к появлению боли, температуры и слабости. Часто воспалению предшествует проникновение бактерий в рану из окружающей среды или вторично через кровь…
Акне: угри у кошекНаличие акне у кошек – частое явление, которое может осложниться дерматитом, привести к расчесыванию и нагноению. Если вы заметили у своего питомца угри, желательно посетить врача и сделать соскоб, чтобы исключить опасные инфекции и последующие осложнения…
Актиномикоз кошекАктиномикоз – заболевание у животных, при котором образуются абсцессы (гнойники) преимущественно на шее или нижней челюсти, которые вызывает грибок из рода актиномицетов.
Асцит – это скопление большого количества жидкости в брюшинной полости, которая сдавливает внутренние органы и мешает их жизнедеятельности…
Герпес у кошек, собакГерпес – заболевание острого или хронического течения, которое поражает слизистые оболочки у животных и сопровождается системными проявлениями…
Глаукома у собак, кошекГлаукома – это заболевание, развивающееся на фоне повышения внутриглазного давления, из-за которого сдавливается сетчатка и мутнеет роговица, появляются местные симптомы…
Демодекоз у кошек, собакКошки и собаки часто страдают таким заболеванием, как демодекоз. Его вызывают клещи Demodex, которые поражают кожу питомца, вызывают сильное раздражение и выпадение шерсти…
Дерматит у собак, кошекДерматит – распространенное заболевание у кошек и у собак. Его провоцируют расстройства различной природы, из-за которых появляется сильный зуд и раздражение кожи. ..
..
Блохи – опасные насекомые, которые питаются кровью зараженного животного. Благодаря сплюснутому тельцу и округлой голове они могут быстро перемещаться даже в густой шерсти, а мощные и длинные задние лапки дают им возможность прыгать на дальние дистанции…
Кальцивироз у кошекасто у домашних кошек появляется такое неприятное заболевание, как кальцивироз. Это вирусная инфекция верхних дыхательных путей, которая может поражать слизистые оболочки полости рта и характеризоваться системными проявлениями…
Катаракта у кошекКатаракта – опасное заболевание у кошек, которое может привести к слепоте. Патология характеризуется помутнением капсулы хрусталика и нарушением его преломляющей способности…
Кератит часто встречается у кошек – это поражение роговицы, при котором она мутнеет и перестает нормально функционировать…
Конъюнктивит у кошекДомашние животные часто страдают конъюнктивитом, заболевание встречается и у кошек. Ему подвержены питомцы в любом возрасте – котята, молодые и взрослые особи…
Ему подвержены питомцы в любом возрасте – котята, молодые и взрослые особи…
Гепатит – это поражение печеночных клеток вирусом, который вызывает их гибель. На месте отмерших гепатоцитов разрастается соединительная ткань, которая не может выполнять утраченные функции…
Гастрит у кошек и собакГастрит – это воспаление слизистой желудка, которое возникает под действием микробных агентов или в результате употребления некачественной пищи…
Гемобартонеллез у кошекГемобартонеллез – это инфекционное заболевание, сопровождающееся анемией. Его вызывают различные вирусы, которые поражают красные кровяные тельца и вызывают их гибель…
Глисты у кошек, собакПаразитарные заболевания у домашних животных встречаются довольно часто, особенно если питомец свободно гуляет по улице и контактирует с другими особями…
Лишай у кошекМногим знакомо такое заболевание у животных, как лишай. Инфекция часто встречается у кошек и характеризуется выпадением кожного покрова вплоть до облысения. ..
..
Атаксия – это нарушение координации и произвольных движений. Причиной этого состояния является поражение двигательных нейронов головного мозга …
Запах изо рта у кошкиЕсли у кошки появился неприятный запах изо рта – стоит задуматься о наличии заболеваний. Он может присутствовать постоянно, появляться утром, в обед или вечером…
Злокачественные опухоли кишечника встречаются редко, но протекают тяжело и дают обширные метастазы. Такие новообразования провоцируют мучительные боли…
Рак крови у кошекРак крови или лейкоз – это поражение костного мозга ретровирусом FeLV, в результате чего вырабатываются дефектные…
Рак лёгких у кошекПри таком заболевании в легких возникает первичная опухоль – онкология сопровождается одышкой и слабостью, на фоне которой отмечается…
Трихофития у собак – симптомы, препараты и способы лечения
Грибковые заболевания считаются одними из наиболее тяжелых и опасных как в ветеринарной, так в медицинской практике.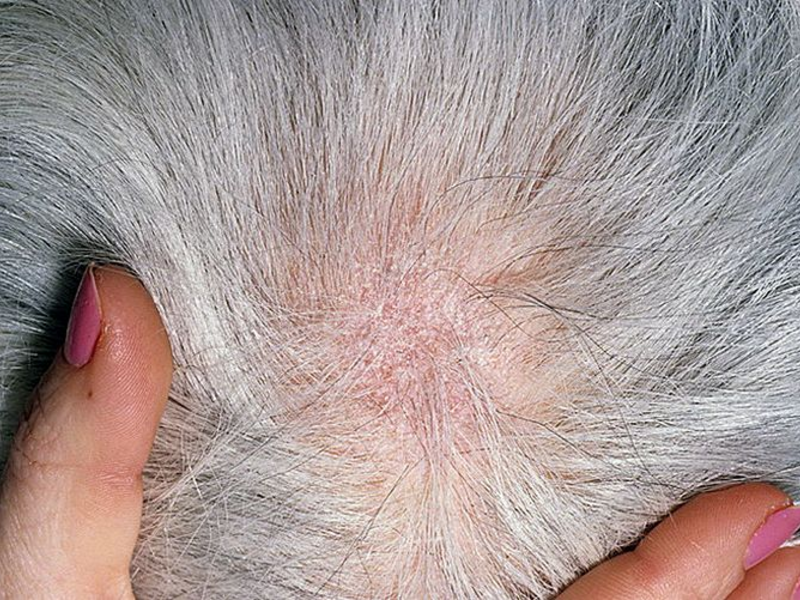 Такое мнение обусловлено сложностью диагностирования и лечения. Убедиться в этом может всякий собаковод: трихофития у собак встречается часто, так что встречаются с ней почти все заводчики.
Такое мнение обусловлено сложностью диагностирования и лечения. Убедиться в этом может всякий собаковод: трихофития у собак встречается часто, так что встречаются с ней почти все заводчики.
Так называется болезнь грибковой этиологии, которая приводит к выпадению волос (второе название – «стригущий лишай»), образованию эрозий и язв на коже. Так как иммунная система при этом заболевании подвергается сильному угнетению, нередки случаи развития вторичных инфекций и обострения имеющихся у животного заболеваний. Трихофития заразна для человека, так что в случае заболевания своего питомца вам придется принимать меры по предотвращению заболевания себя и своей семьи, а также посетить дерматолога во избежание различных неприятностей. Диагностика предполагает использование нескольких методик:
- Микроскопическое исследование кожи и волоса.
- Просвечивание шерсти «черным светом» (специальный источник ультрафиолетового излучения).
- Высев патологического материала на питательную среду.

Последний способ наиболее предпочтителен, так как позволяет с абсолютной точностью выставить диагноз.
Основная симптоматика
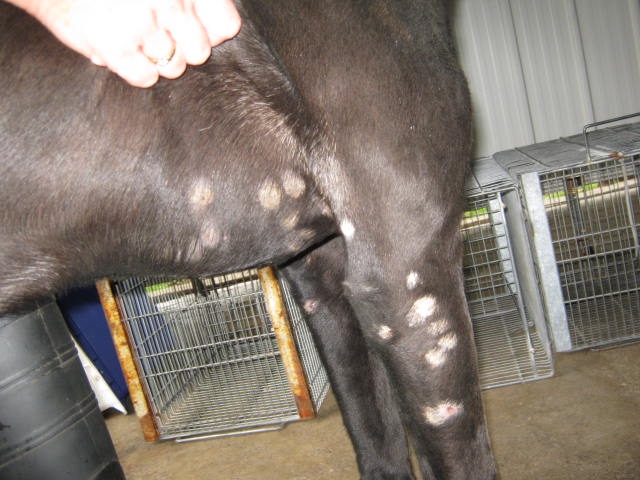
Основные симптомы ясны из названия: сперва образуются небольшие участки, шерсть на которых выпадает. При этом на месте выпавших волос появляются небольшие «пеньки» с расщепленными кончиками. Участки имеют округлую форму, по краям и в центре могут наблюдаться очаги воспаления. Кожа на них быстро сохнет, сморщивается, на ней заметна густая перхоть и шелушащиеся куски. Это можно увидеть на фото. Общее состояние животного чаще всего остается без изменений.
Но все меняется, если пораженную кожу обсеменяет вторичная микрофлора: в этом случае появляются не только очаги воспалений, но и нагноения. Иногда развиваются глубокие язвы, которые плохо заживают. У собаки снижается аппетит, может повышаться общая температура тела, велика вероятность септического процесса. Вот к чему может привести трихофития. В крови у собак при этом заболевании снижается количество иммуноглобулинов, возрастает число лейкоцитов.
Основные препараты, используемые для лечения имеры предосторожности
ИТРАКОНАЗОЛ. Это лекарственное средство в мире уже превалирует над гризеофульвинами, так как имеет меньше побочных эффектов. Механизм его действия основан на блокировании воспроизводства компонентов клеточной мембраны гриба. Чаще всего побочных эффектов у собак не проявляется, но в некоторых случаях бывает рвота и потеря аппетита. Использование каких еще препаратов предполагает лечение?
Гризеофульвины. Это единственная группа антибиотиков, убивающих патогенные грибы. Они действуют на клеточную мембрану актиномицетов, разрушая ее структуру. Если ваш ветеринар назначит этот препарат в форме таблеток, то помните, что их лучше давать после еды, причем пища должна быть жирной. Такая мера минимизирует воздействие лекарства на слизистую оболочку желудка.
Учтите, что гризеофульвин недопустимо использовать в отношении беременных сук, а также собак, которые могут быть пущены в случку раньше, чем через две недели после лечения. Если была допущена сильная передозировка, возможна тошнота, лихорадка, летаргия, диарея, анемия. В случае индивидуальной непереносимости может возникать печеночная недостаточность. Также крайне нежелательно назначать данные препараты собакам с больными почками. Иногда используют другие препараты: Кетоконазол (Nizoral®) и Тербинафин (Lamisil®). Здесь решение зависит от ветеринара. Вот чем лечить эту патологию.
Препараты серы и лечебные вакцины
Как ни странно, но отлично проявляют себя препараты на основе серы. Перед использованием мазей на их основе настоятельно рекомендуем обстричь «налысо» собак длинношерстных пород. Так вы не только увеличите эффективность лечения, но и резко уменьшите количество инфицированных грибом волос. Учтите, что собака сразу после нанесения на ее кожу серы не должна вылизываться, так как вполне вероятна возможность отравления. На протяжении двух-четырех недель (в зависимости от рекомендаций ветеринара) пса каждые два-четыре дня купают. В некоторых случаях серные мази могут вызывать пожелтение кожи, но это явление быстро проходит.
В Советском союзе была разработана уникальная вакцина против трихофитии. На сегодняшний день существует немало ее аналогов, включая препарат «ВАКДЕРМ». Эти средства помогают не только для профилактики: вакцина против трихофитии собак эффективна и в случае уже имеющегося у животного заболевания. Любые вторичные инфекции кожи, такие как фолликулит или пиемия, лечатся при помощи одновременного назначения антибиотиков широкого спектра действия и прочих противомикробных средств.
Насколько велик риск для человека? Советы по «дезактивации» среды
Помните, что трихофития опасна для людей. Дети и старики, а также лица, перенесшие тяжелую болезнь и имеющие ослабленный иммунитет, подвергаются повышенному риску. Напротив, встречаются случаи, когда псы заражаются от своих хозяев. В любом случае, вероятность такого исхода следует всеми силами предотвращать.
Пылесосить дом нужно ежедневно. По возможности, лучше сразу выбрасывать мешок для пыли. Для очистки поверхностей можно использовать хлорный отбеливатель в максимально разрешенной производителем концентрации. Ковры и обивку мебели лучше всего обработать горячим паром. Собачью подстилку/лежак также следует пропаривать, а в конце лечения – выбросить, а лучше сжечь. Если хоть одна ваша собака заболела, придется лечить не только ее, но и всех остальных питомцев. Люди также должны посетить дерматолога. Полотенца, верхнюю одежду и прочие вещи, которые могли соприкасаться с больными животными или людьми, после курса лечения советуем сжигать, так как болезнь передается человеку и ее источники должны быть уничтожены.
Стригущий лишай (трихофития) у собак
ОГЛАВЛЕНИЕ
Введение……………………………………………………………………………3
Глава 1. Стригущий лишай (трихофития) у собак………………………………5
- Определение болезни. Эпизоотические данные. Характеристика возбудителей трихофитии у собак………………………………………….…….5
- Патогенез. Клинические признаки трихофитии у собак…………………..9
Глава 2. Диагностика. Лечение. Профилактика и меры борьбы трихофитии у собак………………………………………………………………………………………………………11
Глава 3. История болезни щенка с диагнозом трихофития……………………18
Заключение……………………………………………………………………….32
Список литературы………………………………………………………………34
ВВЕДЕНИЕ
Актуальность работы. Перед отечественной ветеринарией и микологией остро стоит вопрос о совершенствовании существующих и разработке новых методов диагностики дерматомикозов, а также индикации возбудителей микозов в объектах внешней среды. Изменение экологического фона в ряде республик и областей, процессы урбанизации и связанные с ними изменения структуры и границ нозоареалов этих заболеваний, вносят серьезные изменения в эпидемиологию и влияют на характер клинического течения современных зоонозных дерматомикозов у животных и их владельцев. Это способствует распространению зоонозных дерматомикозов в различающихся по климатогеографическим, экономическим и экологическим условиям ареалах страны [15].
Изучению проблем трихофитии, обусловленной зоофильнымн трихофитонами, посвящены исследования Н.А. Медведевой (1968), П.Н. Пестерева (1988), Э.В Чистяковой (1992). В них освещены особенности морфологии грнбов-возбудителей, вопросы эпидемиологи, патогенеза, клиники и лечения данных микозов. Однако за последнее десятилетие изменились спектр возбудителей и клинические проявления трихофитии, что указывает на необходимость дальнейшего изучения этнологического своеобразия и клинических особенностей последней. Проблеме патогенеза трихофитии, в том числе и изучению процессов иммуногенез при данном микозе, посвящены исследования Ю.А. Медведева (1989) и других авторов [8].
Характерной особенностью всех дерматомикозов и трихофитии у собак, в частности, является видоизменение микробиоты. Если раньше наиболее частыми возбудителями дерматомикозов были антропофильные грибы, то сейчас на их долю приходится не более 1% микобиоты. Основными возбудителями микроспории и трихофитии стали зоофильные грибы. Для трихофитии — это Trichophyton verrucosum и T. mentagrophytes var. gypseum [5].
Цель работы: изучить особенности трихофитии у собак, составить историю болезни щенка с диагнозом трихофития.
Предмет работы: трихофития.
Объект работы: щенок с диагнозом трихофития.
Задачи работы:
1. Дать понятие трихофитии, эпизоотические данные, характеристику возбудителей трихофитии у собак.
2. Рассмотреть патогенез и клинические признаки трихофитии у собак.
3. Изучить методы диагностики, лечение и профилактику трихофитии у собак.
4. Составить историю болезни курируемого щенка с диагнозом трихофития.
Методы исследования: анализ литературы по данной теме, синтез, абстрагирование, обобщение, наблюдение, медицинское исследование.
Объем и структура работы. Курсовая работы изложена на 37 страницах печатного текста. Курсовая состоит из введения, трех глав, включающих параграфы, заключения и списка использованной литературы. Список литературы включает 40 источников, из них 34 отечественных и 6 зарубежных авторов.
ГЛАВА 1. СТРИГУЩИЙ ЛИШАЙ (ТРИХОФИТИЯ) У СОБАК
- Определение болезни. Эпизоотические данные. Характеристика возбудителей трихофитии у собак
Трихофития — распространенное среди дерматомикозов собак заболевание, основными возбудителями которой являются Trichophyton verrucosum и Trichophyton mentagrophytes var. gypseum. Трихофития — природно-очаговая инфекция, эпидемические особенности и периодичность вспышек которой зависят от географических, экологических и ряда других факторов [11].
Источником инфекции является больной человек, животные или почва. Возбудители устойчивы к действию окружающей среды, их споры в высушенном состоянии сохраняют жизнеспособность в течение нескольких месяцев. Передача происходит при контакте с инфицированным человеком или животным либо через предметы обихода. В возникновении патологических процессов на коже определённую роль играют изменения рН среды. В современных природных условиях трихофития имеет ряд характерных особенностей — изменился видовой состав возбудителей. Основным возбудителем является фавиформный трихофитон, удельный вес которого составляет 80-85 % [7].
Возбудитель данной болезни гриб, относящийся к роду Trichophyton. Мицелий гриба не отличается устойчивостью. Споры же весьма устойчивы: в помещениях сохраняются 4-10 лет, на шерсти животных — 12-15 месяцев, в почве — 1,5 года, в навозе и навозной жиже — 8 месяцев, патологическом материале (кожа, волосы) при высушивании — более двух лет. Клетки грибов состоят из оболочки протоплазмы, ядра и ряда включений. Имеют в своем составе жир, витамины, гликоген и кристаллы органических солей. В естественных условиях дерматофиты образуют мицелий, распадающийся на артроспоры, а в культуре на питательных средах — обычно обильный и разнообразный рост. Споры образуются внутри и вне мицелия. Большинство грибов являются аэробами [19].
Tr. mentagrophytes — споры мелкие — 3-5 мкм. Культуры растут быстро, колонии появляются на 3-5-й день, зрелые на 14-16-й день. Колонии белые, кремовые, темно-желтые, могут быть порошистые. Бархатистые. Встречаются спиральные окончания спор. Микроконидии многочисленные, округлые или овальные. Артроспоры отсутствуют. Микроконидии булавовидной формы (рис.1) [21].
Рис.1. Trichophyton mentagrophytes var. gypseum.
Tr. verrucosum — крупноспоровые грибы от 5-ти до 8-ми мкм, поражают волос по типу эктотрикс (рис. 2). Их элементы в большинстве случаев располагаются вне волоса, споровой чехол находится у основания волоса и хорошо выражен. Грибы растут медленно на сусло-агаре или агаре Сабуро. Зрелые колонии появляются на 15-25 день. Колонии белые, серые, кожистые, возвышенные или плоские, складчатые или бугристые, растущий край ровный, лучистый, паутинистый. Мицелий ветвящийся, микроконидии (алейрии) овальные, грушевидные, артроспоры округлой формы. Хламидоспоры терминальные или интеркалярные. Микроконидии удлинённые [34].
Рис.2. Trichophyton verrucosum
Поражения чаще всего обнаруживаются на коже головы (возле носа, глаз), конечностей, шеи; могут быть и на других местах. На пораженных участках вначале наблюдается шелушение кожи и обламывание волос, вследствие чего образуются плешины. Затем на них появляются маленькие, быстро засыхающие пузырьки, покрывающиеся серовато-белыми сухими корками. Участки поражения постепенно увеличиваются, расширяясь к периферии. У больных животных понижается прирост массы тела, снижается качество шерсти и уровень естественной резистентности [10].
Носителями патогенных дерматомицетов являются мыши, крысы и другие грызуны. У собак и кошек стригущий лишай возникает и легко распространяется при нарушении зоогигиенических правил содержания, поэтому особенно часто он встречается у бездомных, бродячих животных. Такие животные представляют наибольшую опасность и для человека (прежде всего для детей). Неблагоприятные погодные условия и поверхностные повреждения кожи способствуют проявлению стригущего лишая [25].
Наиболее часто микроспория и трихофития поражают молодых животных — щенков и котят в возрасте до 1 года. Распространению заболеваний способствует нарушение зоогигиенических и ветеринарно-санитарных правил содержания, кормления и эксплуатации животных (нарушение нормального микроклимата, скученное содержание, перемещения и перегруппировки животных, а также массовая контактная экспертиза во время выставочных мероприятий) [27].
В последние 30-40 лет зооантропонозную трихофитию с атипичной формой локализации патологического процесса не регистрировали. Преимущественным (97,9%) возбудителем заболевания является Trichophyton verrucosum. В 2011 году на территории Российской Федерации было зарегистрировано 2,3 случая трихофитии на 100000 собак. Наиболее часто трихофития встречается в Южном федеральном округе (показатель заболеваемости составил 5,7 и 6,7 на 100000 собак в 2010 и 2011 гг. соответственно). К регионам с высокой заболеваемостью трихофитией у собак относятся республики Башкортостан, Дагестан, Кабардино-Балкария, Ингушетия, Саха (Якутия). На территории Северо-Западного территориального округа Российской Федерации (РФ) трихофития у собак регистрируется спорадически, хотя в последние годы отмечается тенденция к постепенному росту заболеваемости. Этому способствуют активная миграция населения из южных регионов России и Средней Азии, ослабление ветеринарного контроля, слабый уровень знаний о клинической картине трихофитии специалистов-дерматологов и врачей других специальностей [19].
- Патогенез. Клинические признаки трихофитии у собак
Возбудители трихофитии — антропофильные грибы, поражающие гладкую кожу, волосы и ногти. При обитании на коже воспалительные явления неглубокие, нерезко выраженные. Грибы располагаются в сердцевине волоса. Инфильтративно-нагноительная трихофития вызывается грибами, паразитирующими на человеке и животных, т.е. относящимися к группе зооантропофильных. По характеру и свойствам культур на питательных средах они классифицируются как Tr. mentagraphytes (var. gipseum), Tr. verrucosum (var. faviforme). Располагаясь по наружной поверхности волоса и образуя как бы чехол вокруг него. В зависимости от величины спор и их биологических особенностей выделяют мелкоспоровую разновидность, паразитирующую у мелких домашних животных, мышей, крыс, кроликов, морских свинок. Крупноспоровая разновидность обитает у крупных домашних животных -собак, лошадей, коров, телят, овец [39].
Трихофитоны размножаются в тканях, содержащих роговое вещество — керотин, который имеется в роговом слое эпидермиса кожи и в волосе. Возбудитель выделяет токсины и кератолитические ферменты, вызывающие поверхностное воспаление и разрыхление рогового слоя кожи. При условиях, благоприятных для развития, возбудитель проникает к устью волосяных фолликулов и в шейку волоса, разрушает кутикулу, внутреннее волосяное влагалище, корковое вещество, что ведет к нарушению питания волоса и его выпадению. В месте поражения развивается гиперкератоз [2].
Клинические признаки. Инкубационный период длится от недели до месяца. Заболевание протекает хронически и выражается в появлении на коже небольших безволосых пятен округлой формы, покрытых чешуйками и корочками асбестово-серого цвета (рис.3). Чаще всего поражается кожа головы, шеи, конечностей. В запущенных случаях множественные пятна могут сливаться и захватывать значительные участки тела. Зуд отсутствует или слабо выражен [14].
Рис.3. Трихофития у щенка.
При глубокой форме трихофитии у собак происходит нагноение волосяных мешочков, под корками скапливается много гноя. Стригущий лишай может поражать и когти (онихомикоз). В этом случае они становятся толстыми и деформируются. В легких случаях заболевание протекает без зуда. На пораженных местах могут появиться корочки и струпья, которые позже начинают мокнуть. Собака лижет их и пытается чесать. Иногда отмечается обширное поражение кожи. В легких случаях заболевание приводит к выпадению волос и локальному шелушению кожи [18].
ГЛАВА 2. ДИАГНОСТИКА. ЛЕЧЕНИЕ. ПРОФИЛАКТИКА И МЕРЫ БОРЬБЫ ТРИХОФИТИИ У СОБАК
В последние годы отмечается клиническое многообразие трихофитии у собак, наличие атипичных и стертых клинических форм, что, в свою очередь, затрудняет своевременную диагностику. Атипичные формы заболевания необходимо дифференцировать с простым лишаем у собак, розовым лишаем Жибера, псориазом, микробной и себорейной экземой, атопическим дерматитом, гидраденитом, хронической пиодермией, вульгарным сикозом [20].
Поверхностная, инфильтративная и нагноительная формы трихофитии представляют собой последовательные стадии развития патологического процесса. Клиническая картина поверхностной трихофитии достаточно характерна. У собак появляются один или несколько очагов розового цвета, округло-овальной формы, с четкими границами, шелушением; по периферии очагов могут располагаться фолликулярные узелки. При инфильтративной форме очаги поражения резко очерчены, кожа гиперемирована, отечна, инфильтрирована и несколько возвышается над общим уровнем, могут встречаться единичные пустулы, корочки гнойно-геморрагического характера. При развитии процесса на коже часто поражаются пушковые волосы, что приводит к развитию остиофолликулитов; при поражении головы или области бороды и усов волосы обламываются. Нагноительная форма трихофитии у собак чаще развивается на волосистой части головы либо в зоне роста бороды и усов вследствие дальнейшего прогрессирования микотического процесса. Гиперемия кожи в области очага поражения усиливается, появляются множественные фолликулиты, сливающиеся в массивный инфильтрат, значительно выступающий над поверхностью кожи и болезненный при пальпации. Как правило, при нагноительной форме трихофитии наблюдается увеличение регионарных лимфатических узлов, повышение температуры тела, нарушение общего состояния животного. При инфильтративно-нагноительной форме трихофитии волосы в очагах поражения очень легко эпилируются. Зачастую при развитии рубцовых изменений кожи волосы полностью не восстанавливаются [14].
Клинический диагноз трихофитии у собак должен быть подтвержден данными лабораторных исследований. В обычной клинической практике при трихофитии ограничиваются микроскопическим и культуральным методами исследования зараженного материала. Перед микроскопией пораженные объекты (кожные чешуйки, волосы, покрышки пузырьков) предварительно обрабатывают 10%-ным раствором едкого калия или 25%-ным раствором натрия гидроксида для просветления препарата. Поэтому часто этот метод диагностики называют КОН-тестом. Микроскопическая идентификация микромицетов напрямую в клиническом образце является быстрым диагностическим методом, однако наличие ложноотрицательных результатов более чем в 15% случаев указывает на недостаточную специфичность и чувствительность метода. Данным методом можно выявить наличие дерматомицетов, но идентификация их не представляется возможной. Также этот тест ограничивает субъективная оценка врача-лаборанта. Так, чувствительность прямой микроскопии при грибковом поражении головы животного, по данным ряда авторов, варьирует от 67 до 91% [31].
С целью повышения специфичности и чувствительности разработан ряд методик, позволяющих просто и быстро идентифицировать различные виды микромицетов. В микологических лабораториях просветление препаратов для микроскопического исследования проводят 15-30%-ным раствором КОН, в который добавляют 5-10%-ный раствор темно-синих чернил фирмы «Паркер» (Parkers Superchrome Blue-Black Ink). При этом методе гифы и споры дерматомицетов окрашиваются в голубой цвет [25].
В последнее время разработан и внедрен в практику новый метод микроскопии нативных препаратов с окраской калькофлюором белым. Этот реагент в качестве отбеливающего средства используется в текстильной и бумажной промышленности. Совместное применение калькофлюора белого с КОН позволяет выявлять как молодые, так и зрелые гифы дерматомицетов. Применение метода окраски калькофлюором белым при микроскопической диагностике дерматомикозов позволяет на 10% увеличить выявляемость грибковой инфекции по сравнению со стандартным КОН-методом. Краска флуоресцирует в ультрафиолетовом свете (при коротковолновом облучении). Визуализация проводится под флуоресцентным микроскопом [40].
Для окрашивания гистологических срезов волос широко применяют метод PAS (периодическая кислотная реакция) окрашивания. Последний мало отличается от процедуры окрашивания тканевых срезов и сопровождается окраской определенных гликанов (полисахаридов), находящихся в клеточной стенке дерматомицетов. С целью выявления наиболее информативного метода диагностики J. Weinberg и соавт. сравнили четыре диагностических теста, а именно: микроскопический, культуральный, метод люминесцентной микроскопии с белым калькофлюором и биопсии ногтя. Авторы установили чувствительность микроскопии в 80%, культурального метода в 59% и биопсии ногтя — в 92% по сравнению с люминесцентной микроскопией с белым калькофлюором, который был выбран в качестве основного метода. Преимуществом всех вышеперечисленных методик микроскопии является их быстрая и простая техника проведения, однако они не дают возможность идентифицировать вид микромицетов [12].
Для установления видовой принадлежности возбудителя проводится посев материала на питательную среду Сабуро с последующей идентификацией выделенной культуры. Известен способ выделения дерматомицетов на плотной среде Сабуро с селективными добавками в виде пенициллина (20000 ЕД) или стрептомицина (40000 ЕД), гентамицина (0,005 г/л), левомицетина (0,16 г/л). Недостатком данной культуральной среды является медленный рост выделяемых культур, что обуславливает длительные сроки диагностики. С целью сокращения сроков роста культур рядом авторов предложены различные модификации состава среды Сабуро. Описан способ культивирования дерматофитов в жидкой среде, содержащей кератин [28].
З.Р. Хисматуллиной и соавт. был разработан способ идентификации дерматомицетов с использованием культуральной среды Сабуро с гидролизатом кератина, позволяющий сократить сроки выделения грибов из материала больного животного. Увеличение скорости роста культур микромицетов происходит при содержании в питательной среде гидролизата кератина выше 20 г/л. Высев дерматофитов предлагаемым способом позволяет проводить идентификацию для Tr. mentagrophytes var. gypseum на 4-5-й день, для Tr. verrucosum — на 7-8-й день [33].
Одной из попыток усовершенствовать и обеспечить массовую культуральную диагностику дерматомицетов является разработка тестовой среды для дерматофитов (DTM, delmatophyte test medium), содержащей агар Сабуро с антибиотиками, циклогексимидом и индикатором роста культуры дерматофитов. Внедрение среды DTM произвело на свет концепцию «офисного культивирования», при котором появилась возможность наблюдать рост в одноразовых чашках не в специальной лаборатории, а непосредственно в кабинете врача-ветеринара, поскольку рост культуры идет при комнатной температуре [34].
Даже при соблюдении всех правил сбора материала, при наличии оборудования и высоком профессионализме сотрудников лаборатории число выявляемых положительных результатов культурального исследования весьма невелико. Культуральный метод — это специфический диагностический тест, который требует до 8 недель времени, прежде чем результат будет получен. Однако при этом, по данным зарубежной литературы, доля положительного культурального исследования едва достигает 50%, в отечественных исследованиях возбудитель не удается выделить и в 64% случаев. Это обусловлено техническими погрешностями (нарушение правил забора материала, его транспортировки и т.д.), но чаще всего — проведением предшествующей (как правило, местной) антифунгальной терапии у собак их владельцами. Владельцы собак часто занимаются их самолечением с применением наружных антимикотических средств, что приводит не только к изменению клинической картины, но и, естественно, к появлению ложноотрицательных результатов исследования при дерматофитиях [30].
Некоторыми авторами неоднократно предлагались разные диагностические подходы, которые позволили бы усовершенствовать идентификацию грибковой инфекции, дополнить или заменить классические методы. Поэтому, помимо рутинных микроскопического и культурального методов, активно изучаются новые возможности, такие как определение антигена Tr. verrucosum var. verrucosum методом иммуноферментного анализа, а также прямая ДНК-диагностика дерматомицетов. Молекулярно-биологические методики, такие как РСИ — RFLP, ПЦР реального времени и мультиплексный ПЦР, были адаптированы для определения дерматомицетов в клинических образцах. Эти молекулярные методы имеют хороший потенциал для прямого определения дерматомицетов, вместе с тем они еще нуждаются в стандартизации для обычных клинических лабораторий [1].
В 2004 году в России были разработаны и успешно применены в клинических условиях первые генетические зонды для прямой диагностики дерматофитии кожи, волос и ногтей. Данный проект был инициирован в 2003 году Национальной академией микологии с целью изучения возможности применения полимеразной цепной реакции (ПЦР) в выявлении Trichophyton rubrum в клинических образцах. Затем был создан аналогичный метод для Trichophyton mentagrophytes [15].
Лишь несколько авторов сравнивали в клинических образцах КОН-микроскопию и культивирование с ПЦР-методом. В исследовании Nagao и соавт. определили Trichophyton rubrum посредством «вложенной» ПЦР, имеющей мишенью ген внутреннего транскрибируемого спейсера 1 (ВТС1), который был негативен как по данным КОН-микроскопии, так и по данным культивирования. Yan и соавт. сравнили случайно праймируемую ПЦР с общепринятыми методами показали, что случайно праймируемая ПЦР — это более быстрый, чувствительный и специфичный метод для диагностики дерматофитий. Подобных исследований в отношении возбудителей трихофитии у собак не проводилось [28].
В соответствии с общими тенденциями, наблюдаемыми в сфере диагностики, ПЦР реального времени может в будущем стать заменой методам прямой микроскопии и культивирования. Высокая цена ПЦР на сегодняшний день и редкость применения этого метода в ветеринарных клиниках является лимитирующим фактором, но это может измениться в результате уменьшения цен на рынке реагентов и появлением сбережений, вызванных заменой общепринятой диагностики [6].
Таким образом, традиционные доступные методы лабораторной диагностики трихофитии у собак не всегда позволяют определить вид возбудителя и соответственно выбрать оптимальный метод лечения. Назревшая необходимость в методах быстрой и точной идентификации возбудителей открывает перспективы для внедрения в диагностику данного заболевания такого современного, высокочувствительного и специфичного метода исследования, как метод полимеразной цепной реакции [13].
После подтверждения диагноза трихофитии у собак с лечебной целью вводят 2- или 3- кратно вакцину против трихофитии. Одновременно назначают средства, обладающие фунгистатическими и фунгицидными свойствами. В начальном периоде болезни пораженные места обрабатывают раствором салициловой кислоты на 5%-й настойке йода, а также жидкостями и пастами, обладающими фунгицидными свойствами. Достаточно широко представлен ряд готовых фунгицидных форм: фунгин, нитрофунгин; мази: ундециновая, цинкундан, микосептин, «Ям», клотримазол, вединол, экалин, травоген; раствор «Никлофен», эпацид F, Апит. Смазывать или втирать в пораженные участки кожи 2-3 раза в день. Лечебный эффект усиливается при одновременном введении гризеофульвина или низорала. После выздоровления для ускорения роста волос в пораженные участки кожи втирают Carbolici cristall, Ricini и др. Ежедневно втирают в кожу больного животного для стимуляции роста волос [24].
Профилактика трихофитии у животных создает предпосылки для ликвидации трихофитии у человека. Поэтому меры борьбы направлены на выявление и изоляцию больных животных. Их помещают в специальные изоляторы, не чистят и лечат противогрибными средствами. Подстилку сменяют ежедневно, сжигая старую. При профилактике болезни проводят тщательную очистку и дезинфекцию щелочным формалином (500 г каустической соды, 5,5 л формалина и 94 л воды) стен, ограждений, станков, пола. Инструменты, используемые при лечении, следует хорошо дезинфицировать 30%-ной уксусной кислотой или 5%-ным раствором хлорамина. Подозрительных по заболеванию животных наблюдают или подвергают превентивному лечению. Также при профилактики трихофитии необходимо соблюдать гигиенические требования, обеспечивать животных витамином А [26].
При каждом случае заболевания собак возникает необходимость медицинского осмотра всех лиц, находящихся в контакте с животными, и членов их семей. Больных изолируют и лечат. Регулярно сменяют и подвергают дезинфекции постельное белье, а также принадлежности для стрижки и бритья, дети должны носить колпак. Активизируют санитарно просветительную работу среди населения, разъясняя опасность заражения от больных животных и людей и пути распространения болезни. Санитарное просвещение детей проводится в школах [19].
ГЛАВА 3. ИСТОРИЯ БОЛЕЗНИ ЩЕНКА С ДИАГНОЗОМ ТРИХОФИТИЯ
Клинический статус
1. Вид: собака
2. Пол: сука
3. Порода: французский бульдог
4. Дата рождения животного: 15.04.2012
4.1. Возраст: 3 мес.
5. Кличка: Марго
6. Окрас: Палевый
7. Владелец и адрес животного: Антонова К.П., Москва.
8. Дата поступления животного: 08.07.12
9. Диагноз предварительный: Трихофития
10. Диагноз заключительный: Трихофития
11. Дата исхода болезни: 18.07.12
Анамнез
1. Anamnesis vitae. Щенок 3-х месячного возраста, содержится в благоустроенной квартире. Кормление 3-х разовое; утро, обед, вечер. Примерный рацион щенка: мясо — 300 г/сут., крупа овсяная — 100 г/сут., картофель — 40 г/сут., капуста — 40 г/сут., морковь — 30 г/сут., творог — 200 г/сут. Выгул 3 раза в день по 15 минут.
2. Amamnesis morbi. По словам владелицы, щенок заболел 4 июля вечером, что проявилось в появлении слегка заметной сыпи на подбородке, затем произошло увеличение площади поражения, на коже образовалась красноватая корка, а также началось выпадение волос в месте поражения. 6 июля у щенка на пораженном месте образовалась лысина с четкими границами. Из под корки начал течь гной.
Клинический осмотр
1. Общее состояние — Status Praesens. Телосложение: правильное, соответствует породе. Конституция: плотная. Положение: естественное, стоячее. Темперамент: уравновешенный. Упитанность: хорошая.
2. Обследование кожи и шерстного покрова. Кожа сухая непигментированная, эластичная. Волосяной покров блестящий, прочно удерживается, расположен равномерно по всей поверхности тела, кроме пораженной. В области подбородка на коже присутствуют небольшие безволосые пятна округлой формы, покрытые чешуйками и корочками асбестово-серого цвета. Зуд выражен. Происходит небольшое нагноение волосяных мешочков.
3. Обследование лимфатических узлов. Подчелюстные, немного увеличены, подвижные, плотной консистенции, безболезненные, местная температура не повышена. Паховые — подвижны, безболезненны, овально-округлой формы, не увеличены.
4. Обследование слизистых оболочек. Слизистая оболочка конъюнктивы розового цвета, блестящая. Без повреждений. Слизистая рта бледно-розовая, пигментирована. Температура тела животного в прямой кишке на момент приема нормальная.
5. Сердечно-сосудистая система. При пальпации сердечная область безболезненная. Перкуссией определены следующие границы сердца: передняя — по переднему краю 3-го ребра; верхняя — по линии лопатко-плечевого сустава; задняя — до 7-го ребра. Абсолютная тупость сердца в 5 — 6-м межреберьях. При аускультации тоны сердца громкие, четкие, ясные. Артериальный пульс на внутренней стороне бедра ритмичный, равномерно наполнен, частота 100 уд/мин.
6. Дыхательная система. При исследовании носовой полости не обнаружены серозные истечения. Дыхание поверхностное, ритмичное, преобладает брюшной тип дыхания. Частота дыхания: 30 дых. дв./мин. Пальпацией области гортани и трахеи безболезненна.
7. Пищеварительная система. Аппетит снижен, прием корма и воды — свободный. Слизистая ротовой полости бледно-розового цвета, без повреждений. Язык влажный, розовый с белым налетом. Расположение зубов соответствует возрасту животного. Пальпация глотки безболезненна. Слюнные железы не увеличены, безболезненны. Форма живота симметричная. Брюшная стенка безболезненная, умеренно напряжена. При глубокой пальпации обнаруживается желудок. При пальпации области кишечника болезненность отсутствует, при перкуссии звук тимпанический.
Моторика кишечника умеренная, слышны перистальтические шумы. Кишечник безболезненный, умеренно наполнен. При пальпации печень не увеличена, безболезненна, при перкуссии звук тупой. Область печеночного притупления находится справа от 11-го до 13-го межреберья по линии маклока, слева в области 12-го межреберья. По словам владелицы при дефекации животное принимает естественную позу. Фекалии плотные без посторонних включений и слизи.
8. Мочеполовая система. Наружные половые органы собаки без патологических изменений, соответствуют возрасту и полу животного. Истечений из половых органов нехарактерных для животного не наблюдается. При глубокой пальпации обнаруживаются два тела бобовидной формы — почки, левая прощупывается лучше, вследствие более удобного расположения в области в углу левой подвздошной ямки. Болезненной реакции в области почек и мочевого пузыря не наблюдается. В целом при пальпации щенок ведет себя спокойно. По словам владелицы, мочеиспускание происходит в естественной для возраста и пола собаки позе. Моча прозрачная водянистая.
9. Исследования черепа и позвоночного столба. Череп правильной формы, симметричный, соответствует экстерьеру породы. Позвоночный столб без искривлений. При пальпации реберных и позвоночных отростков не обнаружено признаков остеомаляции или смещений. Хвост прямой купированнный. Последние ребра целые, плотные, без рахитозных четок; межреберные пространства ровные.
10. Нервная система. Общее состояние животного угнетенное. Координация движений правильная. Тактильная и болевая чувствительность сохранены.
11. Органы чувств. Постановка глаз правильная, без отклонений. Глазные среды чистые, зрачки слегка расширены, реакция зрачков на свет не замедлена. Помутнений роговицы нет. Радужная оболочка нормального карего цвета, насколько можно судить. Слух не ослаблен, наружные ушные раковины целостные, правильной формы, без покраснений. Неестественные истечения из слуховых отверстий отсутствуют.
Лабораторные исследования
- Общий анализ крови, общий анализ мочи.
Общий анализ мочи от 8.07.12. Цвет мочи соломенно-желтый. Белок отрицательно. Моча прозрачная. Эпителий (плоский) 1-2 в п/з. Лейкоциты 1-2 в п/з. Реакция кислая Уд. Вес 1010. Заключение: в пределах нормы.
Общий анализ крови от 8.07.12.
Эритроциты 4.5*1012 /л
Нb 134 г/л
ЦП 0,93
Лейкоциты 8,0*109
Нейтрофилы 7
Палочкоядерные 0
Сегментоядерные 61
Лимфоциты 29
Моноциты 3
СОЭ 10 мм/ч
Заключение: в пределах нормы.
2.Биохимический анализ крови.
Биохимический анализ крови от 8.07.12.
Общ. Белок 74 г/л
Билирубин общ. 19,4 мкмоль/л
Креатинин 0,08 мкмоль
Тимоловая проба 2,0 Ед
АСТ 14,8 ед/л
АЛТ 21,6 ед/л
Заключение: в пределах нормы.
3. Анализ на грибы пораженного участка кожи щенка.
Обнаружены грибы Trichophyton mentagrophytes var. gypseum.
4. Анализ кала на яйца глистов.
Яиц глистов не обнаружено.
Диагноз и его обоснование
На основании данных анамнеза и клинического исследования животного установлен диагноз: трихофития.
Прогноз лечения
При соблюдении всех пуктов плана лечения щенка, прогноз благоприятный ввиду своевременного обращения в лечебное учреждение и некоторой компетентности хозяина — собаковода со стажем.
План лечения
Лечение трихофитии комплексное. Для устранения этиологического фактора болезни животному необходимо создать оптимальные зоогигиенические условия содержания и кормления. С лечебной целью вводят 2- или 3- кратно вакцину против трихофитии. Одновременно назначают средства, обладающие фунгистатическими и фунгицидными свойствами. В начальном периоде болезни пораженные места обрабатывают раствором салициловой кислоты на 5%-й настойке йода, а также жидкостями и пастами, обладающими фунгицидными свойствами. Достаточно широко представлен ряд готовых фунгицидных форм: фунгин, нитрофунгин; мази: ундециновая, цинкундан, микосептин, «Ям», клотримазол, вединол, экалин, травоген; раствор «Никлофен», эпацид F, Апит. Смазывать или втирать в пораженные участки кожи 2-3 раза в день.
Лечебный эффект усиливается при одновременном введении гризеофульвина или низорала. После выздоровления для ускорения роста волос в пораженные участки кожи втирают Carbolici cristall, Ricini и др. Ежедневно втирают в кожу больного животного для стимуляции роста волос.
Рецепты
1. Rp.: Acidi salicylici 1,0
T-rae jodi spirituosae 5% 10,0
M.D.S. Наружное. Пораженные участки кожи и окружающие здоровые ткани смазывать несколько раз.
2. Rp.: Sol. Fuxini spirituosae 10,0 ml
Sol. Phenoli 5 % 100,0 ml
Ac. borici 1,0
Resorcini 10,0
Acetoni 5,0
M.D.S. Фунгицидное средство. Наносить на пораженные участки кожи (жидкость Кастеллани).
3. Rp.: Sol. Fungini 20 ml
D.S. Смазывать пораженные участки кожи 2-3 раза в день.
4. Rp.: Tab. Griseofulvini 0,125 N.40
D.S. Внутрь по 1 таблетке по 1 таблетке 2 раза в день — 1 неделю.
5. Rp.: 01. Ricini 25,0
Tannini 5,0
Spiritus aethylici 95 % 150, 0
Ol. Sinapis actherei 2,0
M.D.S. Ежедневно втирать в кожу для стимуляции роста волос.
Течение болезни
Дата | t °C | Пульс | ЧД | Симптомы | Лечение |
8.07.12 | 37, 6 | 100 | 30 | Угнетенное состояние, общая слабость, повы-шенная температура тела, увеличение регио-нарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безво-лосые пятна округлой формы, покрытые че-шуйками и корочками асбестово-серого цвета. Зуд. Нагноение воло-сяных мешочков. | Введение вакци-ны против три-хофитии. Сма-зывание пора-женных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 раза в день. Гризеофульвин внутрь по 1 таб. 2 раза в день. |
9.07.12 | 37,5 | 99 | 32 | Угнетенное состояние, общая слабость, повы-шенная температура тела, увеличение регио-нарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безво-лосые пятна округлой формы, покрытые че-шуйками и корочками асбестово-серого цвета. Зуд. Нагноение воло-сяных мешочков. Ухудшений не наблю-дается. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
10.07.12 | 37,4 | 87 | 34 | Угнетенное состояние, общая слабость, повы-шенная температура тела, увеличение регио-нарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безво-лосые пятна округлой формы, покрытые че-шуйками и корочками асбестово-серого цвета. Зуд. Нагноение воло-сяных мешочков. Ухудшений не наблю-дается. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
11.07.12 | 37,2 | 97 | 29 | Угнетенное состояние, общая слабость, повы-шенная температура тела, увеличение регио-нарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безво-лосые пятна округлой формы, покрытые че-шуйками и корочками асбестово-серого цвета. Зуд. Нагноение воло-сяных мешочков. Ухуд-шений не наблюдается. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
12.07.12 | 37,3 | 94 | 30 | Угнетенное состояние, общая слабость, повы-шенная температура тела, увеличение регио-нарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безво-лосые пятна округлой формы, покрытые че-шуйками и корочками асбестово-серого цвета. Зуд не выражен. Нагноение волосяных мешочков уменьша-ется. Ухудшений не наблюдается. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
13.07.12 | 37,2 | 85 | 31 | Общее состояние улу-чшилось, температура тела снизилась, увели-чение регионарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безволосые пятна округлой формы, покрытые чешуйками и корочками асбес-тово-серого цвета. Зуд не выражен. Нагное-ние волосяных ме-шочков уменьшается. Ухудшений не наблю-дается. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
14.07.12 | 37,1 | 90 | 25 | Общее состояние улу-чшилось, температура тела снизилась, увели-чение регионарных лимфоузлов, снижение аппетита. В области подбородка на коже небольшие безволосые пятна округлой формы, покрытые чешуйками и корочками асбес-тово-серого цвета. Зуд не выражен. Нагное-ние волосяных ме-шочков уменьшается. Ухудшений не наблю-дается. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
15.07.12 | 37,1 | 88 | 28 | Общее состояние улу-чшилось, температура тела снизилась, регио-нарные лимфоузлы уменьшились, аппетит улучшился. Зуд не выражен. Нагноение волосяных мешочков прекратилось. Шелу-шение пораженного участка уменьшилось. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
16.07.12 | 37 | 94 | 30 | Общее состояние удов-летворительное, собака подвижна, температура тела в норме, аппетит в норме. Зуда нет. Наг-ноение волосяных ме-шочков прекратилось. Шелушение не выра-жено. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
17.07.12 | 36,9 | 99 | 30 | Общее состояние в норме, собака под-вижна, температура те-ла в норме, аппетит в норме. Пораженные участки кожи восста-навливаются. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
18.07.12 | 36,9 | 98 | 29 | Общее состояние в норме, собака под-вижна, температура те-ла в норме, аппетит в норме. Пораженные участки кожи восста-навливаются. | Смазывание по-раженных мест раствором сали-циловой кисло-ты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 р. в день. Гризео-фульвин внутрь по 1 таб. 2 раза в день. |
После выздоровления для ускорения роста волос в пораженные участки кожи необходимо втирать Carbolici cristall, Ricini и др. Ежедневно втирают в кожу больного животного для стимуляции роста волос.
Рис. 4. График температуры, пульса и частоты дыхания щенка с трихофитией в дни протекания болезни.
Эпикриз
Трихофития — распространенное среди дерматомикозов собак заболевание, основными возбудителями которой являются Trichophyton verrucosum и Trichophyton mentagrophytes var. gypseum. Трихофития у собак встречается чаще чем другие дермофитии. Болеют обычно щенки, плохо питающиеся собаки, а также животные с пониженным за счет другого заболевания иммунитетом. Источником возбудителя являются больные и переболевшие животные. Это кожное заболевание передается собакам от других животных через поврежденные участки кожи, путем контакта со спорами, находящимися в земле, на игрушках и мебели.
Больная собака, французский бульдог, сука, 15.04.2012 г.р. находится на лечении с 08.07. по 18.07. 2012 года с диагнозом: нагноительная трихофития подбородка (1 очаг). При поступлении владелица собаки предъявила жалобы на появление у щенка слегка заметной сыпи на подбородке, затем произошло увеличение площади поражения, на коже образовалась красноватая корка, а также началось выпадение волос в месте поражения. 6 июля у щенка на пораженном месте образовалась лысина с четкими границами. Из под корки начал течь гной.
Проведено обследование: физикальное, анализ на грибы, ОАК, ОАМ, БХ крови.
Проведено лечение: введена вакцина против трихофитии. Пораженные места в течение 10 дней обрабатывались раствором салициловой кислоты на 5%-й настойке йода, а также фунгином и жидкостью Кастеллани 2 раза в день. Одновременно вводился гризеофульвин внутрь по 1 таб. 2 раза в день. После выздоровления для ускорения роста волос в пораженные участки кожи рекомендовано втирание Carbolici cristall или Ricini ежедневно.
Заболевание у щенка протекало с типичными клиническими признаками. Назначенное лечение оказало должный эффект, т.к. выздоровление наступило в минимальные сроки. Рекомендуется более расширенный рацион и более полноценное питание.
ЗАКЛЮЧЕНИЕ
Трихофития — (Trichophytosis), трихофитоз, стригущий лишай, инфекционная болезнь животных и человека, вызываемая несовершенными грибами рода Trichophyton, характеризующаяся у животных появлением на коже участков с обломанными волосами, покрытых корками и чешуйками. Распространена в большинстве стран мира, в том числе и в России.
Т. verrucosum вызывает главным образом трихофитию крупного рогатого скота, зебу, буйволов, верблюдов, реже серебристо-чёрных лисиц, песцов. T. mentagrophytes (gypseum) — основной возбудитель трихофитии собак, кроликов, серебристо-чёрных лисиц, песцов, мышей-полёвок, сусликов, а также зверей, содержащихся в зоопарках, питомниках и др.[17].
Трихофитией болеют животные всех видов и возрастов. Источники инфекции — больные и переболевшие животные. Факторы передачи — инфицированные помещения, инвентарь. Мышевидные грызуны — постоянный резервуар T. mentagrophytes в природе. Инфицированные возбудителями трихофитии сено, солома, пух, волос, шерсть служат источником заражения кроликов, пушных зверей, крупного рогатого скота, овец, лошадей. Микротравмы способствуют внедрению возбудителя. В зверохозяйствах, кролиководческих комплексах, откормочных совхозах, питомниках, где концентрируется большое поголовье животных, трихофития может протекать как энзоотия [21].
Переболевшие трихофитией животные приобретают длительный напряжённый иммунитет. Показатели серологических реакций (РА, РСК) сохраняются лишь 2-3 месяца, через 6-8 месяцев они могут полностью угаснуть. При поверхностной трихофитии заражение людей (особенно часто детей) происходит при контакте с больным животным и через инфицированные предметы. На коже появляются округлые розовые пятна с чёткими приподнятыми краями и шелушением в центре. В очагах на волосистой части головы волосы разрежены и обломаны. Поражённые ногти — грязно-серые, тусклые, неровные, края их утолщены, крошатся. Глубокая трихофития возникает при заражении грибами, паразитирующими у животных (особенно опасны больные трихофитией пушные звери, собаки, кролики и кошки). Отмечают воспалительные нагноившиеся узлы с корками на поверхности, облысение [35].
СПИСОК ЛИТЕРАТУРЫ
- Авилов В.М. Ветеринария. — СПб.: Питер, 2006. — 338 с.
- Азаров В.Н. Основы микробиологии и санитарии. — М.: Экономика, 1996. — 205 с.
- Антонов В.Б., Медведева Т.В., Леина Л.М. и др. К вопросу об инфильтративно-нагноительной трихофитии // Успехи медицинской микологии. Т. 8. — М.: Национальная академия микологии, 2006. — С. 185 -187.
- Астраханцев В.И. Болезни собак. — М.: Колос, 2001. — 258 с.
- Белов Е.П. Болезни собак. — М.: Агропромиздат, 1990. — 368 с.
- Борисов Л.Б. Медицинская микробиология, вирусология, иммунология.- М.: Медицинское информагенство, 2005.- 735 с.
- Воробьев А.А. Медицинская и санитарная микробиология.- М.: Академия, 2003.- 462 с.
- Ветеринарная лабораторная медицина. Интерпретация и диагностика: [собаки, кошки, лошади, жвачные животные, свиньи]. Мейер Д., Харви Дж. М.: Софион, 2007.- 458 с.
- Глотова Т. И. Дерматомикозы собак и кошек в условиях города//Ветеринария, 1998, № 1. С. 59-61.
- Гинзбург А.Г. Организация и планирование ветеринарного дела. — М.: Аспект-Пресс, 2005. — 492 с.
- Гусев М.В. Микробиология. — М.: Академия, 2009. — 464 с.
- Евсеенко К.А. Новые горизонты медицинской микологии// Мед. новости. — 2003. — Т. 12. — С. 4-9.
- Кашкин П. H, Лисин В. В. Практическое руководство по медицинской микологии. — Л.: Медицина, 1990. -195 с.
- Kyxap E.В. Поиск антигенов для ИФА-диагностики зооантропонозной трихофитии // Проблемы мед. микол. — 2007. — Т. 2. — С. 73 — 74.
- Лещенко П. Н. Лабораторная диагностика грибковых заболеваний. — М.: Медицина, 1987. 146 с.
- Литвинов A.M. Дерматофитозы кошек и собак (профилактика и лечение)//Ветеринария. № 11, 2000. С.51-53.
- Луферов А.Ф. Методические рекомендации по оздоровлению домашних очагов зооантропонозной микроспории и трихофитии. Минск: Высшая школа. 1998. — 15 с.
- Лысак В.В. Микробиология. — Минск: БГУ, 2007. — 426 с.
- Медведева Г. В., Антонов В. Б., Леина Л. М. и др. Трихофития: современные представления об этиологии, клинической картине, особенностях диагностики и терапии // Клин. дерматол. и венерол. — 2007. — Т. 4. — С. 70 — 74.
- Медведев К.С. Болезни кожи собак и кошек / К.С. Медведев. Киев: ВИМА, 1999.-218 с.
- Медицинская микробиология. / Под ред. А.М. Королюка, С.Б. Стойчакова. — СПб.: ЭЛБИ, 2002.- 267 с.
- Микробиология и иммунология. / Под ред. А.А. Воробьева.- М.: Медицина, 2005.- 492 с.
- Минеева Л.А. Микробиология. — М.: Академия, 2010. — 464 с.
- Нуралиев М.Д. Эпидемиология, особенности клиники и совершенствование терапии трихофитии в условиях жаркого климата. — Душанбе, 2007.- 200 с.
- Организация и экономика ветеринарного дела / Под ред. А.Д. Третьякова. — М.: Проспект, 2001. — 260 с.
- Основы микробиологии, вирусологии и иммунологии. / Под ред. Ю.С. Кривошеина.- М.: Высшая школа, 2001.- 224 с.
- Петрович С.В. Микозы животных. М.: Росагропромиздат. — 1989. — 173 с.
- Райкис Б. Общая микробиология с вирусологией и иммунологией. — М.: Триада — Х, 2002.- 347 с.
- Саркисов А.Х. Диагностика грибных болезней животных/А.Х. Саркисов, В.П. Королева, Е.С. Квашнина, В.Ф. Грезин//М.: Колос. — 1971. — 144 с.
- Справочник ветеринарного врача / Под ред. Н.М. Алтухова. — М.: Колос, 1996. — 352 с.
- Степанова Ж.В., Гребенюк В.Н., Воробьева И.А. и др. Диагностические ошибки при зооантропонозной трихофитии // Вестн. дерматол. — 2001. — Т. 6. — С. 36-38.
- Федюк В.И. Справочник болезней собак и кошек.- М: Академия. — 2001. — 338 с.
- Хисматуллина 3. Р. Мухамадеева О. Р. Способ выделения дерматофитов//Вестн. дерматол. — 2006. — Т. 2. — С. 25-27.
- Хисматуллина З.Р., Фахретдинова X. С, Мухамадеева О.Р. Зооантропонозная трихофития. — Уфа: Башкириздат, 2004. 125 с.
- Arabatzis М, Bruijnesteijn van Coppenraet L.E. S., Kuijper E.J. et al. Diagnosis of common dermatophyte infections by a novel multiplex real-time polymerase chain reaction detection/identification scheme // Br. J. Dermatol. — 2007. — Vol. 157.-P. 681-689.
- Jennings M.B., Rinaldi M.G. Confirmation of dermatophytes in nail specimens using in-office dermatophyte test medium cultures. Insights from a multispecialty survey //J. Am. Podiatr. Med. Assoc. — 2003. — Vol. 93, №3. — P. 195-202.
- Rippon J. W. Medical mycology // The Pathogenic Fungi and the Pathogenic Actinomycetes 3rd ed. — Philadelphia: WB Saunders, 1988.
- WeinbergJ.M., KoestenblattE.K., Tutrone W.D. etal Comparison of diagnostic methods in the evaluation of onychomycosis // J.Am. Acad. Dermatol. — 2003. — Vol. 49, №2. — P. 193-197.
- Yang G., Zhang M., Li W. et al Direct species identification of common pathogenic dermatophyte fungi in clinical specimens by semi-nested PCR and restriction fragment length polymorphism //Mycopathologia. — 2008. — Vol. 166, №4. — P. 203-208.
- Yan D. Detection of fungiinliquor workers with tinea corporis and tinea cruris using arbitrarily primed polymerase chain reaction // Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi. — 2007. — Vol. 25, №3. — P. 133-135.
PAGE \* MERGEFORMAT 3
Ветеринарное направление » Трихофития собак и кошек
17 декабря 2019
Одно из наиболее распространенных кожных болезней мелких домашних животных, вызываемых простейшими грибками, является трихофития. Грибки трихофитоны (род Trichophyton sp.) относятся к дерматофитам, которые для своего роста и развития предпочитают кожные покровы животных и людей, хотя могут размножаться на мёртвом субстрате – опавших листьях, траве и почве.
Заболевание передается контактным путем от больного животного к здоровому через споры. От собак и кошек может заразиться и человек.
Попадая на кожу споры оказываются в благоприятных условиях и начинают прорастать. Из них появляются тонкие нити – гифы мицелия, которые внедряются в толщу эпидермиса. Выделяя токсины грибок вызывает местную воспалительную реакцию, которая в начале проявляется в виде сильно зудящих мелких прыщей, локализованных на относительно небольшой площади кожи, которая воспаляется, становится отёчной и может стать влажной от сочащейся лимфы.
Если заболевание начинается с волосистой части, то в месте роста грибка волос становится ломким и обламывается на высоте 0,5-1 см от поверхности кожи. Участок роста грибка выглядит как бы подстриженным, от чего трихофитии в давние времена получила народное название «стригущий лишай».
Самым тяжелым проявлением лишая является парша, при которой кожа покрывается плотной коркой засохшего гноя в виде пчелиных сот, а располагаться она может как на коже, так и на слизистых оболочках.
Для медицинских и ветеринарных специалистов-дерматологов, которые определяют тактику и стратегию лечения, стригущего лишая важно знать, какова степень поражения, как много спор выделил грибок, каков их размер и где они расположены – снаружи или внутри волоса.
Если споры расположены на поверхности, то для их уничтожения, прежде всего, будут эффективны наружные обработки противогрибковыми мазями, спреями и растворами. Если споры расположены внутри волоса и толще кожи, то лучший результат лечения может быть достигнут путём применения противогрибковых таблетированных препаратов, которые даются внутрь длительным курсом или вакцины, содержащей инактивированный мицелий грибка трихофитон.
Точная диагностика трихофитии проводится специалистами ФГБУ «Краснодарская МВЛ» путём микроскопического исследования пораженного волоса и кожи, а также выделение грибка на специальных питательных средах, что позволяет выявлять болезнь на ранних стадиях.
Для точной диагностики наилучший результат может быть достигнут, если больное животное будет доставлено на обследование в нашу лабораторию, где специалисты самостоятельно проведут все необходимые диагностические процедуры. В случае отсутствия технической возможности привести животное на обследование, в лабораторию доставляются волосы пораженного участка, извлеченные из кожи вместе с корнями в полиэтиленовом пакете с зип-лок замком. Срок доставки материала – 1 сутки с момента его отбора.
Трихофития имеет сходные признаки с другим, гораздо более заразным видом стригущего лишая – микроспорией, опасной для всех видов домашних животных, а также клещевой чесоткой (демодекозом). По этой причине самым верным решением будет провести максимально возможную диагностику кожных болезней Вашего питомца в нашей лаборатории.
Необычные проявления дерматофитии у собак
Дерматофития – это заболевание, вызванное тропными к кератинизированным тканям грибами – представителями родов Microsporum, Trichophyton и Epidermophyton.
Дерматофиты делятся в зависимости от резервуара (источника) заражения на:
- зоофильные (животные): Microsporum canis, M.gallinae, M.nanum, Trichophyton verrucosum.
- лесные (грызуны, ежики): Trichophyton mentagrophytes, Microsporum persicolor.
- геофильные (почва): Microsporum gypseum, M.fulvum, M.vanbreuseghemii, M.cookei.
- антропофильные (человек): Trichophyton tonsurans, T.rubrum, Epidermophyton floccosum, Microsporum audouinii.
По распространенности у собак и кошек лидирует Microsporum canis (70%). Также встречается Microsporum gypseum (15%), Trichophyton mentagrophytes (10%) и Microsporum persicolor (5%).
В этой статье я хочу поделиться двумя своими клиническими случаями дерматофитии у собак.
Случай №1На прием была доставлена 9-ти месячная нестерилизованная сука породы Бишон Фризе. Вакцинации согласно возрасту. Обработки от эктопаразитов – флураланер 8 недель назад. Содержание квартирное. Аппетит, жажда в норме.
Жалобы на кожные поражения на морде, на вылизывание межпальцевых промежутков на передних конечностях, помутнение роговицы на обоих глазах.
На клиническом осмотре: Т,П,Д – норма. Видимые слизистые бледно — розовые, умеренно влажные. Лимфоузлы (подчелюстные, подмышечные) – без особенностей. Алопеция, эритема, эксфолиации на морде, в области губ, в периорбитальной области симметрично на обоих глазах. Межпальцевые промежутки на всех конечностях — эритема, с пальмарной и плантарной сторон – эритема, отечность, эксфолиации. НСП – норма. Спина, бока, живот, грудь, подмышки – норма. Правый глаз – язва роговицы, левый глаз – помутнение роговицы.
Дифференциальные диагнозы: ювенильный целлюлит/стерильный панникулит, лекарственная реакция, дерматофития (керион), поверхностная пиодерма, бактериальный фурункулез, малассезиозный дерматит, демодекоз.
- В соскобах клещей Demodex canis не обнаружено.
- Трихоскопия – волосы нормального строения, нет пораженных дерматофитами волос в препарате. Люминесцентная диагностика – отрицательно.
- В цитологическом исследовании мазка-отпечатка с кожи: малассезии +++.
Предварительный диагноз: малассезиозный дерматит.
Не исключенные диагнозы: ювенильный целлюлит/стерильный панникулит, лекарственная реакция, дерматофития (керион), бактериальный фурункулез.
Назначена противогрибковая терапия (Ирунин) + местные обработки кожи в межпальцевых промежутках 3% раствором уксуса до результатов гистологии и рекомендована консультация офтальмолога.
Заключение по биопсийному материалу.
Морфологический диагноз: фурункулез, пиогранулематозный перифолликулярный дерматит. Этиологический диагноз: с подобной гистологической картиной могут протекать следующие заболевания (в порядке убывания вероятности в данном случае): бактериальный фурункулез, керион (дерматофития), ювенильный целлюлит / стерильный панникулит, синдром стерильной гранулемы / пиогранулемы, инфекционный пиогранулематозный процесс.
Взята гистология (2 биоптата с помощью панча).
На фото собака через 4 недели лечения Ирунином.
После получения результатов гистологического исследования было принято решение о дополнительном PAS – окрашивании гистосрезов для исключения дерматофитии (кериона).
После 14 –дневного курса приема Ирунина владелец отмечает уменьшение покраснения кожи, снижение зуда, появление роста новой шерсти (единичные волосы). Собака активна, аппетит в норме. Принято решение до результатов PAS — окраски перейти на «пульсовый» прием Ирунина. Также собака получает лечение, назначенное офтальмологом.
На фото Трихофитон. Гистосрез.
Заключение по гистосрезам с PAS – окраской – дерматофития (предположительно – трихофития).
В общей сложности собака получала противогрибковое лечение на протяжении 9 недель.
Случай №23-х годовалый некастрированный кобель породы лабрадор — ретривер. Вакцинирован согласно возрасту. Обработки от эктопаразитов отсутствуют.
Жалобы: хромает на левую тазовую конечность, постоянно лижет лапу. Заметили несколько дней назад.
На клиническом осмотре: Т,П,Д – норма. Видимые слизистые бледно — розовые, умеренно влажные. Лимфоузлы (подчелюстные, подмышечные, паховые) – без особенностей. Голова, спина, бока, подмышечные впадины, живот, пах – норма. Грудные конечности – норма. На левой тазовой конечности плантарно очаговая алопеция, эритема, узел. Межпальцевые промежутки в норме. Правая тазовая конечность – норма. НСП – норма.
Дифференциальные диагнозы: бактериальный фурункулез как следствие травмы, демодекоз, дерматофития (керион), новообразование неясной этиологии.
В соскобах клещей Demodex canis не обнаружено.
Трихоскопия – обнаружены волосы, пораженные дерматофитами.
Диагноз: дерматофития (керион).
Собаке было назначено противогрибковое лечение (Ирунин).
Через 2,5 недели керион незначительно уменьшился в размере, а в области 3, 4 межпальцевых промежутков стали визуализироваться 2 вскрывшихся свища.
Цитологическое исследование отделяемого из свища: споры дерматофитов ++, палочки+, нейтрофилы дегенеративные +++, макрофаги++.
Окончательный диагноз: дерматофития (керион), глубокая бактериальная инфекция.
Собаке также был назначен курс антибиотика.
Через 2 недели свищи отсутствовали, кожа 3,4 межпальцевых промежутков в норме. На месте кериона появился рост новой шерсти, отечности и эритемы не было. Общая длительность лечения составила 8 недель.
дерматофитозов у животных | SpringerLink
Romano C, Valenti L, Barbara R. Дерматофиты, выделенные от бессимптомных бездомных кошек. Микозы 1997; 40: 471–2.
PubMed CAS Google Scholar
Борман А.М., Кэмпбелл К.К., Фрейзер М., Джонсон Е.М. Анализ видов дерматофитов, изолированных на Британских островах в период с 1980 по 2005 год, и обзор мировых тенденций в отношении дерматофитов за последние три десятилетия.Med Mycol. 2007; 45: 131–41.
PubMed Google Scholar
Chermette R. Isolement de Microsporum persicolor à partir de lésions cutanées d’un chien et de sa propriétaire atteinte d’une double dermatophytie. Bull Soc Fr Mycol Méd. 1981; 10: 219–23.
Google Scholar
Ролик JA, Westblom TU. Microsporum nanum Инфекция у свиноводов.J Am Acad Dermatol. 1986; 15: 935–9.
PubMed CAS Google Scholar
Pönnighaus JM, Warndorff D, Port G. Microsporum nanum — отчет из Малави (Африка). Микозы 1995; 38: 149–50.
PubMed Google Scholar
Хуовинен С., Туннела Э., Хуовинен П., Куиджперс А.Ф., Сухонен Р. Онихомикоз человека, вызванный Trichophyton equinum , переданным от скаковой лошади.Br J Dermatol. 1998. 138: 1082–4.
PubMed CAS Google Scholar
Амор Э., Гутьеррес М.Дж., Ламонеда С., Дель Паласио А., Перейро М. Лечение тербинафином инфекции Trichophyton equinum у ребенка. Clin Exp Dermatol. 2001; 26: 276–8.
PubMed CAS Google Scholar
Poblete-Gutiérrez P, Abuzahra F, Becker F, Krause H, Merk HF, Frank J.Онихомикоз у больного диабетом, вызванный Trichophyton gallinae . Микозы 2006; 49: 254–7.
PubMed Google Scholar
Del Palacio A, Pereiro-Miguens M, Gimeno C, Cuetara MS, Rubio R, Costa R, Romero G. Распространенный дерматофитоз, вызванный Microsporum ( Trichophyton ) gallinae у больного СПИДом — отчет из Испании. Clin Exp Dermatol. 1992; 17: 449–53.
PubMed Google Scholar
King D, Cheever LW, Hood A, Horn TD, Rinaldi MG, Merz WG. Первичные инвазивные кожные инфекции Microsporum canis у пациентов с ослабленным иммунитетом. J Clin Microbiol. 1996; 34: 460–2.
PubMed CAS Google Scholar
Porro AM, Yoshioka MC, Kaminski SK, Palmeira Mdo C, Fischman O, Alchorne MM. Диссеминированный дерматофитоз, вызванный Microsporum gypseum , у двух пациентов с синдромом приобретенного иммунодефицита.Mycopathologia 1997; 137: 9–12.
PubMed CAS Google Scholar
Berg JC, Hamacher KL, Roberts GD. Псевдомицетома, вызванная Microsporum canis у пациента с ослабленным иммунитетом: описание случая и обзор литературы. Дж. Кутан Патол. 2007; 34: 431–4.
PubMed Google Scholar
Cabañes FJ. Дерматофиты домашних животных.В кн .: Биология дерматофитов и других кератинофильных грибов. Rev Iberoam Micol. 2000. 17: 104–108.
Hubaleck Z. Кератинофильные грибы, ассоциированные с свободноживущими млекопитающими и птицами. В биологии дерматофитов и других кератинофильных грибов. Rev Iberoam Micol. 2000. 17: 93–103.
Gräser Y, De Hoog S, Summerbell RC. Дерматофиты: распознавание видов клональных грибов. Med Mycol. 2006; 44: 199–209.
PubMed Google Scholar
Gallo MG, Lanfranchi P, Poglayen G, Calderola S, Menzano A, Ferroglio E, Peano A. Сезонное 4-летнее исследование роли альпийского сурка ( Marmota marmota ) как переносчика зоофильных дерматофитов. Med Mycol. 2005; 43: 373–9.
PubMed CAS Google Scholar
Галло М.Г., Тиццани П., Пеано А., Рэмбоцци Л., Менегуз П.Г. Хвост восточный ( Sylvilagus floridanus ) как переносчик дерматофитных грибов.Микопатология 2005; 160: 163–6.
PubMed CAS Google Scholar
Pier AC, Smith JMB, Alexiou H, Ellis DH, Lund A, Pritchard RC. Стригущий лишай животных — его этиология, значение для общественного здравоохранения и меры борьбы с ним. J Med Vet Mycol. 1994; 32 (Приложение 1): 133–50.
PubMed Google Scholar
Smith JMB, Jolly RD, Georg LK, Connole MD. Trichophyton equinum var. autotrophicum ; его характеристики и географическое распространение. Sabouraudia 1968; 6: 296–304.
PubMed CAS Google Scholar
Ричард Дж. Л., Деби М.С., Черметт Р., Пирс А.С., Хасегава А., Лунд А., Братберг А.М., Падай А.А., Коннол М.Д. Успехи ветеринарной микологии. J Med Vet Mycol. 1994; 32: 169–87.
PubMed Google Scholar
Мориелло К.А., DeBoer DJ.Грибковая флора шерсти домашних кошек. Am J Vet Res. 1991; 52: 602–6.
PubMed CAS Google Scholar
Abdel-Gawad KM. Грибки на когтях буйвола и коровы в Египте. J Basic Microbiol. 1989; 29: 323–8.
PubMed CAS Google Scholar
Шерметт Р., Буссьерас С., Жанмонод П., Крокенуа С. Dermatophytie à Trichophyton rubrum chez un chien et son propriétaire.Описание премьеры во Франции. Bull Soc Fr Mycol Méd. 1990; 19: 219–23.
Google Scholar
Кушида Т., Ватанабе С. Стригущий лишай собак, вызываемый Trichophyton rubrum ; вероятная передача от человека животному. Sabouraudia 1975; 13: 30–2.
PubMed Google Scholar
Кано Р., Хираи А., Йошиике М., Нагата М., Накамура И., Ватанабэ С., Хасегава А.Молекулярная идентификация изолята Trichophyton rubrum от собаки с помощью анализа гена хитинсинтазы 1 (CHS1). Med Mycol. 2002; 40: 439–42.
PubMed CAS Google Scholar
Brilhante RSN, Cordeiro RA, Gomes JMF, Sidrim JJC, Rocha MFG. Дерматофитоз собак, вызванный антропофильными видами: молекулярная и фенотипическая характеристика Trichophytontonsurans . J Med Microbiol. 2006; 55: 1583–6.
PubMed CAS Google Scholar
Террени А.А., Грегг В.Б. младший, Моррис П.Р., ДиСальво А.Ф. Epidermophyton floccosum Инфекция у собаки из США. Sabouraudia 1985; 23: 141–2.
PubMed CAS Google Scholar
Стенвиг Х., Таксдал Т. Выделение Epidermophyton floccosum от собаки в Норвегии. Sabouraudia 1984; 22: 171–2.
PubMed CAS Google Scholar
Flamant F, De Gentile L, Chermette R, Chabasse D, Bouchara JP. Flore fongique des lésions de la carapace des torrestres de compagnie dans l’Ouest de la France. J Mycol Méd. 2003. 13: 67–72.
Google Scholar
Thomas AD, Sigler L, Peucker S, Norton JH, Nielan A. Chrysosporium , анаморф Nannizziopsis vriesii , связанный со смертельными кожными микозами у морских крокодилов ( Crocodylus porosus ).Med Mycol. 2002; 40: 143–51.
PubMed CAS Google Scholar
Bowman MR, Paré JA, Sigler L, Naeser JP, Sladky KK, Hanley CS, Helmer P, Phillips LA, Brower A, Porter R. Глубокий грибковый дерматит у трех бородатых драконов внутри страны ( Pogona vitticeps ) вызывается анаморфом Chrysosporium из Nannizziopsis vriesii . Med Mycol. 2007. 45: 371–6.
PubMed Google Scholar
Фрай FL. Уход за рептилиями. Атлас болезней и методов лечения. т. 1. Мельбурн, Флорида: Krieger Publishing; 1991. стр. 101–16.
Google Scholar
Сарджисон Н.Д., Томсон Дж. Р., Скотт П.Р., Хопкинс Г. Стригущий лишай, вызываемый Trichophyton verrucosum — возникающая проблема у овечьих отар. Vet Rec. 2002; 150: 755–6.
PubMed CAS Google Scholar
Cafarchia C, Romito D, Sasanelli M, Lia R, Capelli G, Otranto D.Эпидемиология дерматофитозов собак и кошек в Южной Италии. Микозы 2004; 47: 508–13.
PubMed CAS Google Scholar
Циммерман К., Фельдман Б., Робертсон Дж., Херринг Э.С., Мэннинг Т. Дермальный аспират массы персидской кошки. Vet Clin Pathol. 2003. 32: 213–7.
PubMed Google Scholar
Descamps F, Brouta F, Vermout S, Monod M, Losson B, Mignon B.Рекомбинантная экспрессия и антигенные свойства кератинолитической субтилизин-подобной протеазы массой 31,5 кДа из Microsporum canis . FEMS Immunol Med Microbiol. 2003. 38: 29–34.
PubMed CAS Google Scholar
Moriello KA, DeBoer DJ, Greek J, Kuhi K, Fintelman M. Распространенность реакций гиперчувствительности немедленного и замедленного типа на антигены Microsporum canis у кошек. J Feline Med Surg. 2003. 5: 161–6.
PubMed CAS Google Scholar
Mancianti F, Giannelli C, Bendinelli M, Poli A. Микологические находки у кошек, инфицированных вирусом иммунодефицита кошек. J Med Vet Mycol. 1992; 30: 257–9.
PubMed CAS Google Scholar
Sierra P, Guillot J, Jacob H, Bussiéras S, Chermette R. Грибковая флора на кожных и слизистых поверхностях кошек, инфицированных вирусом иммунодефицита кошек или вирусом кошачьей лейкемии.Am J Vet Res. 2000. 61: 158–61.
PubMed CAS Google Scholar
Mignon BR, Losson BJ. Распространенность и характеристика носительства Microsporum canis у кошек. J Med Vet Mycol. 1998. 35: 15–9.
Google Scholar
Льюис Д.Т., Фойл С.С., Хосгуд Г. Эпидемиология и клинические особенности дерматофитоза у собак и кошек в Государственном университете Луизианы, 1981/1990.Vet Dermatol. 1991; 2: 53–8.
Google Scholar
Пинтер Л.Дж., Юрак З., Укалович М.М., Сушич В. Эпидемиологические и клинические особенности дерматофитозов у собак и кошек в Хорватии в период с 1990 по 1998 год. Ветархив. 1999; 69: 261–70.
Google Scholar
Копетти М.В., Сантурио Дж.М., Карвалейро А.С., Бек А.А., Аргента Дж.С., Агиар Л.С., Алвес Ш. Дерматофиты, выделенные от собак и кошек с подозрением на дерматофитию в южной Бразилии.Acta Scientiae Veterinariae. 2006; 34: 119–24.
Google Scholar
Mancianti F, Nardoni S, Cecchi S, Corazza M, Taccini F. Дерматофиты, выделенные у собак и кошек с симптомами в Тоскане, Италия, в течение 15-летнего периода. Микопатология 2002; 156: 13–8.
PubMed CAS Google Scholar
Pier AC, Moriello KA. Паразитарные отношения между Microsporum canis и кошкой.Med Mycol. 1998; 36 (Дополнение 1): 271–5.
PubMed Google Scholar
Pinard M, Chermette R, Bussiéras S. Диагностика и профилактика домашних хищников. Этюд критического анализа в рамках enquête à l’Ecole Nationale Vétérinaire d’Alfort. Rec Méd Vét. 1987. 163: 1107–16.
Google Scholar
Гамбале В., Ларссон К.Э., Моритами М.М., Корреа Б., Паула С.Р., Фрамил ВМД.Дерматофиты и другие грибы шерсти кошек без дерматофитов в городе Сан-Паулу, Бразилия. Feline Pract. 1993; 21: 29–33.
Google Scholar
Guzman-Chavez RE, Segundo-Zaragoza C, Cervantes-Olivares RA, Tapia-Perez G. Присутствие кератинофильных грибов, особенно дерматофитов, на шерсти собак и кошек в городах Мексика и Незауалькойотль. Rev Latinoam Microbiol. 2000; 42: 41–4.
PubMed CAS Google Scholar
Pascoe RR. Исследования распространенности стригущего лишая среди лошадей в скаковых и племенных конюшнях. Aust Vet J. 1976; 52: 419–21.
PubMed CAS Google Scholar
Феррейро Л. Этиопатогенные инфекции à Microsporum canis . Etude d’une exoprotéase kératinolytique [Диссертация]. Кретей, Франция: Université Paris 12, 1995. 193 стр.
Kwong-Chung KJ, Bennett JE. Дерматофитозы.В медицинской микологии. Филадельфия: Леа и Фабигер, 1992: 105–161.
Bourdin M, Destombes P, Parodi AL, Drouhet E. Segretain G. Первое наблюдение за микетомом на Microsporum canis chez un chat. Rec Méd Vét. 1975; 151: 475–80.
Google Scholar
Ягер Дж. А., Уилкок Б. П., Линч Дж. А., Томпсон А. Р.. Мицетомоподобная гранулема у кошки, вызванная Microsporum canis . J Comp Pathol.1986; 96: 171–6.
PubMed CAS Google Scholar
Medleau L, White-Weithers NE. Дерматофития у кошек. Компендиум 1991; 13: 557–63.
Google Scholar
Nardoni S, Franceschi A, Mancianti F. Идентификация Microsporum canis из дерматофитной псевдомицетомы в залитых в парафин ветеринарных образцах с использованием общего протокола ПЦР.Микозы 2007; 50: 215–7.
PubMed CAS Google Scholar
Ринальди М.Г., Ламазор Э.А., Рознер Э.Х., Вегнер С.Дж. Мицетома или псевдомицетома? Микопатология 1983; 81: 41–8.
PubMed CAS Google Scholar
Коэффициенты FC, Arai T, Disalvo F, Evans EG, Hay RJ, Randhawa HS, Rinaldi MG, Walsh TJ. Номенклатура грибковых заболеваний: отчет и рекомендации подкомитета Международного общества микологии человека и животных (ISHAM).J Med Vet Mycol. 1992; 30: 1–10.
PubMed CAS Google Scholar
Hay RJ, Mahgoub ES, Leon G, Al-Sogair S, Welsh O. Mycetoma. J Med Vet Mycol. 1992; 30 (Дополнение 1): 41–9.
PubMed Google Scholar
Петерс Дж., Скотт Д.В., Эрб Х.Н., Миллер У.Х. мл. Сравнительный анализ дерматофитоза собак и поверхностной пузырчатки на распространенность дерматофитов и акантолитических кератиноцитов: гистопатологическое и клиническое ретроспективное исследование.Vet Dermatol. 2007; 18: 234–40.
PubMed Google Scholar
Черметт Р., Бюссьер Дж., Бурдо П. Deux cas de dermatophytie double et généralisée dans l’espèce canine. Bull Soc Fr Mycol Méd. 1982; 11: 205–10.
Google Scholar
Абрамо Ф., Верчелли А., Манчианти Ф. Два случая дерматофитной псевдомицетомы у собак: иммуногистохимическое исследование.Vet Dermatol. 2001; 12: 203–7.
PubMed CAS Google Scholar
Knudtson WU, Gates CE, Ruth GR, Haley LD. Trichophyton mentagrophytes Дерматофитоз диких лисиц. J Wildl Dis. 1980; 16: 465–8.
PubMed CAS Google Scholar
Scott DW. Дерматология крупных животных. Филадельфия: У. Б. Сондерс; 1988. 487 с.
Lefèvre PC, Blancou J, Chermette R, eds. Дерматофилоза. В: «Принципиальные болезни инфекционных заболеваний и паразитарных заболеваний», Том 2. Париж: Лавуазье; 2003. с. 977–92.
Скотт Д.Б. Вспышка стригущего лишая у каракульских овец, вызванная физиологическим вариантом Trichophyton verrucosum Bodin. Onderstepoort J Vet Res. 1975; 42: 49–52.
PubMed CAS Google Scholar
Джексон РБ, Пил Б.Ф., Дональдсон-Вуд К.Эндемическая инфекция Microsporum canis у овец. Aust Vet J. 1991; 68: 122.
PubMed CAS Google Scholar
Sharp MW, Lupson GR, Flamank M. Microsporum canis Инфекция овец. Vet Rec. 1993; 132: 388.
PubMed CAS Google Scholar
Эль-Тимави А.М., Седдик I, Атия М. Стригущий лишай верблюда в Верхнем Египте. Асьют Вет Мед Дж.1988; 20: 53–9.
Google Scholar
Махмуд А.Л. Дерматофиты и другие ассоциированные грибы, выделенные при поражении стригущим лишаем верблюда. Folia Microbiol. 1993; 38: 505–8.
CAS Google Scholar
Фадлельмула А., Агаб Х, Ле Хорн Дж. М., Аббас Б., Абдалла А. Е.. Первое выделение Trichophyton verrucosum как этиологии стригущего лишая у суданских верблюдов ( Camelus dromedarius ).Преподобный Элев Мед Вет платит троп. 1994; 47: 184–7.
PubMed CAS Google Scholar
Thedford TR, Johnson LW. Инфекционные болезни верблюдовых (NWC) Нового Света. Ветеринарная клиника North Am Food Anim Pract. 1989. 5: 145–57.
PubMed CAS Google Scholar
Иванова Л.Г. Культурные, морфологические и биологические свойства возбудителя стригущего лишая верблюда.Труды Всесоюзного института экспериментальной ветеринарии, 1987; 65: 54–60 [В: ParasiteCD 1989–2001, SilverPlatter Information, CAB International].
Google Scholar
Хамиев СК. [Клинические признаки стригущего лишая у двугорбых верблюдов и дромадеров]. Ветеринария, Москва, СССР, 1981; 70: 38–9. [RU].
Куттин Э.С., Алханати Э., Фельдман М., Хаимовиц М., Мюллер Дж. Дерматофития верблюдов. J Med Vet Mycol. 1986; 24: 341–4.
PubMed CAS Google Scholar
Gitao CG. Распространенность инфекции Dermatophilus congolensis у верблюдов в четырех районах выращивания в Кении и наличие смешанной инфекции Trichophyton verrucosum . Isr J Vet Med. 1998. 53: 89–93.
Google Scholar
Morganti L, Bianchedi M, Ajello L, Padhye A. Первый европейский отчет об инфицировании свиней Microsporum nanum .Mycopathologia 1976; 59: 179–82.
PubMed CAS Google Scholar
Фишман О., Сантьяго М. Инфекция Microsporum canis у свиньи. Mycopathol Mycol Appl. 1966; 30: 271–2.
PubMed CAS Google Scholar
Gonzalez-Cabo JF, Latre-Cequiel MV, Solans-Aisa C, Verde-Arribas MT. Дерматофития свиней, вызываемая Trichophyton mentagrophytes .Микопатология 1988; 101: 161–4.
PubMed CAS Google Scholar
Lindemann D, Böhm KH. [Распространение инфекции Microsporum canis на сельскохозяйственном предприятии (описание случая)]. Берл Мунк Tierarztl Wochenschr. 1994; 107: 413–6. [Статья на немецком языке].
PubMed CAS Google Scholar
Gonzalez-Cabo JF, Barcena-Asensio MC, Gomez-Rodriguez F, Amigot-Lazaro JA.Вспышка дерматофитии свиней, вызванная Microsporum canis . Микопатология 1995; 129: 79–80.
PubMed CAS Google Scholar
Ollhoff RD, Siesenop U, Bohm KH. Свинья как аномальный хозяин Trichophyton verrucosum . Tierarztl Prax. 1997; 25: 353–5.
PubMed CAS Google Scholar
Сон YW, Xie Z, Li RF, Jian HD, Xu HC.Диагностический отчет о дерматомикозе свиней, вызванном Trichophyton violaceum . Chin J Vet Med. 1999; 25: 20–1.
Google Scholar
Манчианти Ф., Миньоне В., Папини Р. Кератинофильные грибы шкур диких кабанов в Италии. J Wildl Dis. 1997; 33: 340–2.
PubMed CAS Google Scholar
Минтай С. Грибковые болезни лабораторных грызунов.Ветеринарная клиника North Am Exot Anim Pract. 2003; 6: 401–13.
PubMed Google Scholar
Fonseca E, Mendoza L. Favus у боевого петуха, вызванного Microsporum gallinae . Птичий Дис. 1984; 28: 737–41.
PubMed CAS Google Scholar
Дроуал Р., Бикфорд А.А., Уокер Р.Л., Ченнинг С.Е., Макфадден К. Фавус в стае куриц на заднем дворе. Птичий Дис.1991; 35: 625–30.
PubMed CAS Google Scholar
Брэдли Ф.А., Бикфорд А.А., Уокер Р.Л. Диагностика фавуса (птичьего дерматофитоза) у кур восточной породы. Птичий Дис. 1993; 37: 1147–50.
PubMed CAS Google Scholar
Брэдли Ф.А., Бикфорд А.А., Уокер Р.Л. Эффективность нитрата миконазола против фавуса у кур восточной породы. Птичий Дис.1995; 39: 900–1.
PubMed CAS Google Scholar
Gründer S, Mayser P, Redmann T, Kaleta EF. Микологические исследования на грибковую флору куриного гребня. Микозы 2005; 48: 114–9.
PubMed Google Scholar
Карузо К.Дж., Коуэлл Р.Л., Коуэлл А.К., Мейнкот Дж. Х. Соскоб кожи с кошки. Vet Clin Pathol. 2002; 31: 13–5.
PubMed Google Scholar
Мариат Ф, Адан-Кампос С. Техника карре-де-тапи, простой метод предварительной подготовки к суперсильным микозам. Энн Инст Пастер. 1967; 113: 666–8.
CAS Google Scholar
Маккензи DWR. «Расческа-диагностика» в выявлении и искоренении нефлуоресцентного стригущего лишая кожи головы. Br Med J. 1963; 10: 363–5.
Артикул Google Scholar
Мориелло К.А.Методы диагностики дерматофитий. Clin Tech Small Anim Pract. 2001; 16: 219–24.
PubMed CAS Google Scholar
Carrol HF. Оценка дерматофитной тест-среды для диагностики дерматофитии. J Am Vet Med Assoc. 1974; 165: 192–5.
Google Scholar
Гийо Дж., Латье Л., Девиль М., Халос Л., Шерметт Р. Оценка тест-среды на дерматофиты RapidVet-D.Vet Dermatol. 2001; 12: 123–7.
PubMed CAS Google Scholar
Пинтер Л., Ноубл В.С., Эллис Дж., Чиклитира П.Дж. Значение иммуноферментного анализа (ELISA) в серологической диагностике дерматофитии собак, вызванной Microsporum canis . Vet Dermatol. 1992; 3: 65–70.
Google Scholar
Garcia ME, Guedeja-Marron J, Lazaro M, Blanco JL.Мониторинг дерматофитоза собак иммунодиагностическим методом. Vet Rec. 2004. 154: 116–7.
PubMed CAS Google Scholar
Пеано А, Рэмбоцци Л., Галло М.Г. Разработка иммуноферментного анализа (ИФА) для серодиагностики дерматофитии собак с помощью Microsporum canis . Vet Dermatol. 2005; 16: 102–7.
PubMed Google Scholar
Hill PB, Moriello KA, Shaw SE. Обзор системных противогрибковых средств. Vet Dermatol. 1995; 6: 59–66.
Google Scholar
Shelton GH, Grant CK, Linenberger ML, Albokovitz JL. Тяжелая нейтропения, связанная с приемом гризеофульвина у кошек. J Vet Intern Med. 1990; 4: 317–9.
PubMed CAS Google Scholar
Colombo S, Cornegliani L, Vercelli A.Эффективность итраконазола в качестве комбинированной непрерывной / импульсной терапии при дерматофитиях кошек: предварительные результаты в девяти случаях. Vet Dermatol. 2001; 12: 347–50.
PubMed CAS Google Scholar
Van Cauteren H, Heykants J, De Coster R, Cauwenbergh G. Итраконазол: фармакологические исследования на животных и людях. Rev Infect Dis. 1987; 9 (Дополнение 1): S43–6.
PubMed Google Scholar
Mancianti F, Pedonese F, Millanta F, Guarnieri L. Эффективность перорального тербинафина при дерматофитиях кошек, вызванном Microsporum canis . J Feline Med Surg. 1999; 1: 37–41.
PubMed CAS Google Scholar
Мориелло К.А. Лечение дерматофитии у собак и кошек: обзор опубликованных исследований. Vet Dermatol. 2004. 15: 99–107.
PubMed Google Scholar
Ben-Ziony Y, Arzi B. Использование луфенурона для лечения грибковых инфекций у собак и кошек: 297 случаев (1997–1999). J Am Vet Med Assoc. 2000; 217: 1510–3.
PubMed CAS Google Scholar
Guillot J, Malandain E, Jankowski F, Rojzner K, Fournier C, Touati F, Chermette R, Seewald W., Schenker R. Оценка эффективности перорального луфенурона в сочетании с местным энилконазолом для лечения дерматофитоза питомники.Vet Rec. 2002; 150: 714–8.
PubMed CAS Google Scholar
Патерсон С. Шампунь с миконазолом / хлоргексидином в качестве дополнения к системной терапии для борьбы с дерматофитозом у кошек. J Small Anim Pract. 1999; 40: 163–6.
PubMed CAS Google Scholar
Патерсон С. Дерматофития у 25 лошадей — протокол лечения с использованием местной терапии.Equine Vet Educ. 1997; 9: 171–3.
Артикул Google Scholar
Ньюбери С., Мориелло К., Вербрюгге М., Томас С. Использование известковой серы и итраконазола для лечения кошек из приютов, естественно инфицированных Microsporum canis , в дополнительном помещении: испытание в открытом поле. Vet Dermatol. 2007. 18: 324–31.
PubMed Google Scholar
Hofbauer B, Leitner I, Ryder NS.Чувствительность in vitro Microsporum canis и других изолятов дерматофитов от ветеринарных инфекций во время терапии тербинафином или гризеофульвином. Med Mycol. 2002; 40: 179–83.
PubMed CAS Google Scholar
Rycroft AX, Mclay C. Дезинфицирующие средства для борьбы со стригущим лишаем мелких животных, вызванным Microsporum canis . Vet Rec. 1991; 129: 239–41.
PubMed CAS Google Scholar
Moriello KA, Deboer DJ, Schenker R, Blum JL, Volk LM. Эффективность предварительного лечения луфенуроном для профилактики инфекции Microsporum canis в модели прямого местного заражения кошек. Vet Dermatol. 2004. 15: 357–62.
PubMed Google Scholar
Гуддинг Р., Лунд А. Иммунопрофилактика дерматофитии крупного рогатого скота. Кэн Вет Дж. 1995; 36: 302–6.
PubMed CAS Google Scholar
Mackenzie DWR, Loeffler W, Mantovani A, Fujikura T. Рекомендации по диагностике, профилактике и контролю дерматофитозов у человека и животных. WHO / CDS / VPH / 86.67 1986. 82 с.
Pier AC, Zancanella PJ. Иммунизация лошадей против дерматофитии, вызванной Trichophyton equinum . Equine Pract. 1993; 15: 23–7.
Google Scholar
(PDF) Дерматофития, вызванная Trichophyton mentagrophytes var.erinacei у собаки: отчет о болезни
Veterinarni Medicina, 59, 2014 (7): 349–351 История болезни
351
(Hata et al. 2000; Cerundolo and Maiolino 2002; Riley
and Chomel 2005). Информация владельца о
присутствии ежей вокруг
участков выгула собаки позволила нам предположить возможность прямого или косвенного заражения
T. mentagrophytes
var. erinacei происходит от ежей.Наличие
ежей, зараженных T. mentagrophytes
var. erinacei вокруг мест выгула собак является важным фактором риска, способствующим передаче
этой инфекции собакам и, возможно, людям, которые
контактируют с инфицированными собаками и ежами
или зараженными объектами. Системные противогрибковые препараты, включая
, включая итраконазол, обеспечивают устранение грибковой инфекции
, в то время как местные противогрибковые препараты снижают на
загрязнение окружающей среды дерматофитами (Catherine 2006).Мы наблюдали заметное улучшение клинических симптомов на
в ответ на лечение
итраконазолом и клотримазолом.
В заключение, T. mentagrophytes var. erinacei
следует включать в дифференциальную диагностику
гнойных поражений кожи мошонки собак, которые могли
контактировать с ежами. Кроме того,
ветеринаров должны знать о зоонозном потенциале
T. mentagrophytes var.erinacei инфекция.
Благодарность
Авторы хотели бы поблагодарить Оркуна Бабаджана
(Университет Анкары, Анкара, Турция) за выполнение
микробиологических исследований и завершение
диагноза в этом случае.
ССЫЛКИ
Arenas R, Sonia T, Isa RI (2006): Kerion и дерматофитная
гранулема. Микологические и гистопатологические данные
у 19 детей с воспалительным дерматитом волосистой части головы
волосистой части головы.Международный журнал дерматологии 45, 215–219.
Бернардо Ф., Ланка М., Герра М., Мартинс Х.М. (2005): Der-
матофитов, выделенных от домашних животных, собак и кошек в Лиссабоне,
Португалия (2000–2004). Revista Portuguesa de Ciencias
Veterinarias 100, 85–88.
Екатерина А (2006): Микологические заболевания кожи. Clin-
ical Техники в работе с мелкими животными 21, 128–134.
Cerundolo R, Maiolino P (2002): Кожные поражения мошонки
собак.Ветеринарная дерматология 13, 63–76.
Chermette R, Ferreiro L, Guillot J (2008): Дерматофитозы
у животных. Mycopathologia 166, 385–405.
Connole MD (1968): Стригущий лишай, вызванный Trichophyton men —
тагрофитов у собак. Австралийский ветеринарный журнал 44,
528.
Хата Й, Амагаи М., Нака В., Харада Р., Нишикава Т. (2000):
Два случая инфекции Trichophyton mentagrophytes
заразились от хомяка и шиншиллы.Nihon
Ishinkin Gakkai Zasshi 41, 269–273.
Hsieh CW, Sun PL, Wu YH (2010): Заражение Trichophyton erinacei
от ежа: отчет о случае из Тайваня.
Mycopathologia 170, 417–421.
Menelaos LA (2006): Дерматофитоз у собак и кошек. Бул-
летин УСАМВ-ЦН 63, 304–308.
Miletta MD, Schwartz MD, Sperling MD (2014): Tinea
capitis, имитирующий рассекающий целлюлит волосистой части головы: топатологическая ловушка his-
при оценке алопеции у пубертатного пациента после
.Журнал кожной патологии 41, 2–4.
Nenoff P, Krüger C, Hanselmayer GG, Tietz H (2014):
Mycology-an update. Часть 1: Дерматомикозы: возбудители
, эпидемиология и патогенез. Journal der
Deutschen Dermatologischen Gesellschaft 12, 188–210.
Padhyee AA, Ajello L (1977): таксономический статус гриба-ежа
Trichophyton erinacei. Sabouraudia
15, 103–114.
Pier AC, Smith JMB, Alexiou H, Ellis DH, Lund A, Pritchard
RC (1994): стригущий лишай животных — его этиология, общественное здравоохранение
значение и контроль.Journal of Medical and Veteri-
nary Mycology 32, 133–150.
Pierard-Franchimont C, Hermanns JF, Collette C, Pierard
GE, Quatresooz P (2008): Стригущий лишай ежа у человека
человека и собаки. Acta Clinica Belgica 63, 322–324.
Пинтер Л., Стритоф З. (2004): ретроспективное исследование инфекции Tricho-
phyton mentagrophytes у собак (1970–2002 гг.).
Ветеринарский архив 74, 251–260.
Quaife RA (1996): Инфекция человека, вызванная грибком hedgehog
, Trichophyton mentagrophytes var.erinacei.
Журнал клинической патологии 19, 177–178.
Райли PY, Chomel BB (2005): Hedgehog Zoonoses. Emerg-
Инфекционные болезни 11, 1–5.
Sidwell RU, Chan I, Francis N, Bunker CB (2014): Tricho-
phyton erinacei kerion barbae от ежа с
прямой оскулярной передачей другому человеку. Клиника и
Экспериментальная дерматология 39, 38–40.
Получено: 2014–03–11
Принято после исправлений: 2014–08–14
Автор для переписки:
E.К. Чолакоглу, Университет Анкары, факультет ветеринарной медицины, кафедра внутренней медицины,
06110 Анкара, Турция
Электронная почта: [email protected]
(PDF) Ретроспективное исследование инфекции Trichophyton mentagrophytes у собак (1970-2002)
259
Вет. архив 74 (4), 251-260, 2004
Lj. Пинтер и З. Штритоф: ретроспективное исследование инфекции Trichophyton mentagrophytes у собак
BRGLEZ, I. (1991): Вклад в изоляцию дерматофитов у собак и кошек.Zb.
Вет. Фак. Univ. Любляна 28, 11-18.
CABANES, FJ, F. MANCIANTI, MP TAMPIERI, MG GALLO, L. PINTER, B.
MIGNON, R. FABIKOVA, A. TOMSIKOVA, A. WEBER, MJ PAYA, MT CUTULI
(2003): Обзор дерматофитозов кошек и собак в Европе. Направления медицинской микологии
49-54. Труды ISSI.
ГАЛУППИ, Р., М. С. КАРЕЛЬ, М. П. ТАМПЬЕРИ (2002): Эпидемиологические особенности
дерматофитозов у животных: пять лет диагностической деятельности (1995-1999).Obiettivi e
Documenti Veterinari 23, 51-54.
HAJSIG, M., T. NAGLI, D. HAJSIG, V. HORVAT, P. LUKMAN, A. OVI (1983):
Дерматопитозы у грызунов. IV. Передача Trichophyton mentagrophytes от
кроликов стригущего лишая свиньям. Вет. архив 53, 251-257.
HAJSIG, M., V. SERTIÆ, T. NAGLIÆ, M. BAUER (1975): Первые результаты инфекций Microsporum
gypseum и M. canis у собак и кошек в Загребе. Вет. архив 45, 117-122.
КРИСТЕНСЕН, С., Х. ВИГГО КРОГ (1981): Исследование кожных заболеваний у собак и кошек.
Норд. Вет. Med. 33, 134-140.
MANCIANTI, F., S. NARDONI, S. CECCHI, M. CORAZZA, F. TACCINI (2002):
Дерматофиты, выделенные от собак и кошек с симптомами в Тоскане, Италия, в течение
15-летнего периода. Mycopathol. 156, 13-18.
MANCIANTI, F., S. NARDONI, M. CORAZZA, P. D ’ACHILLE, C. PONTICELLI (2003):
Экологическое обнаружение артроспор Microsporum canis в домохозяйствах
инфицированных кошек и собак.J. Feline Med. Surg. Sci. Прямой. (В печати)
МАНТЕЛЛИ, Ф., М. СОММАРИВА (1988): Дерматомикозы у собак и кошек. Сумма 5,
186-188.
MEDLEAU, L. (1990): недавно описанные дерматозы. Вет. Clin. Small Anim. 20, 1623-
1632.
MEDLEAU, L., P. M. RAKICH (1994): Псевдомицетомы Microsporum canis у кошки.
J.A.A.H.A. 30, 573-576.
ПАРКЕР У. М., Я. А. ЯГЕР (1997): Trichophyton dermatophytosis — болезнь, которую легко спутать
с красной пузырчаткой.Может. Вет. J. 38, 502-505.
PINTER, L., Ž. JURAK, M. UKALOVIÆ, V. SUŠI (1999): Эпидемиологические и клинические особенности
дерматофитозов у собак и кошек в Хорватии в период с 1990 по 1998 год. Ветеринар.
архив 69, 261-270.
РЕБЕЛЛ, Г., Д. ТАПЛИН (1970): Дерматофиты: их распознавание и идентификация.
Университет Майами Пресс. Флорида.
СКОТТ, Д. У., В. Х. МИЛЛЕР, К. Э. ГРИФФИН (1995): Грибковые кожные заболевания. Muller и
Kirk’s Small Animal Dermatology, 5-е изд.Филадельфия, У. Б. Сондерс. С. 330-389.
SERTIÆ, V., M. HAJSIG, T. NAGLI (1973): Дерматофитозы у собак со ссылкой на
других кожных заболеваний у плотоядных животных. Вет. архив 43, 210-218.
Возникновение различных патогенных и условно-патогенных грибов при кожных заболеваниях домашних животных: ретроспективное исследование | BMC Veterinary Research
Наш ретроспективный анализ был сосредоточен на образцах от животных с клиническими признаками кожных заболеваний ( наружный отит, и различные формы дерматита) и показал, что у 56 животных.Выделено 47% обследованных животных, грибы, относящиеся к разным морфологическим группам. Мы обнаружили базидиомицетные и аскомицетные грибы, включая дрожжи Malassezia и Candida , условно-патогенные плесени, например Alternaria , а также типичные дерматофиты. В группе животных, страдающих дерматитом, дрожжи были обнаружены в 56,2% положительных культур ( Malassezia pachydermatis в 29,1%, Candida spp. В 27,1% соответственно), а дерматофиты были этиологическими агентами кожных заболеваний в 23 случаях. .5% случаев. Переносчиками дерматофитов являются кошки и другие домашние животные, такие как кролики, морские свинки или собаки [15, 16]. Кроме того, оборудование животного, такое как щетки, ошейники, матрасы или места отдыха для собак и кошек, может быть источником инфекции, поскольку споры дерматофитов обладают высокой устойчивостью в окружающей среде в течение длительного периода времени. Среди всех микозов кожи дерматофитозы относятся к зоонозам и могут передаваться от животных к человеку. В литературе описаны клинические случаи одновременного возникновения дерматофитоза у животного s и его хозяина, например, у его хозяина.грамм. Инфекция Trichophyton rubrum , сосуществующая у человека и свиньи [23], и у собаки [24], или микроспороз, передаваемый от кошки детям [14].
Кроме того, один из тех, кто проводил это исследование, перенес дерматофитию после контакта с инфицированными животными во время отбора проб и с клиническими образцами во время повторных диагностических микологических процедур (рис. 5.). В этом случае Arthroderma benhamiae (анаморф Trichophyton mentagrophytes ) культивировали из соскобов кожи (данные не опубликованы).Также мы заметили типичные для дерматофитоза поражения кожи на предплечье женщины, владеющей домашним кроликом, из которой мы изолировали Microsporum canis . Эти результаты согласуются с литературными данными за несколько лет, описывающими инфекции Trichophyton mentagrophytes и Microsporum canis как наиболее распространенные этиологические агенты дерматомикоза человека в Польше [25, 26, 27]. Среди рода Trichophyton в некоторых случаях мы также выделяли геофильный Trichophyton terrestre ( Arthroderma insingulare ).В нашем предыдущем исследовании, посвященном микологическому скринингу, мы не наблюдали присутствия спор дерматофитов в окружающей среде здоровых животных, их ошейниках или берлогах [11], однако мы не можем исключить эти источники.
Рис. 5Tinea manuum , заказанный персоналом лаборатории.
В ходе наших исследований мы культивировали различные формы, такие как Aspergillus, Penicilium или Paeciliomyces . Однако при культивировании образцов волос или мазков с кожи животных рост такой плесени в окружающей среде следует рассматривать как загрязнение, поскольку их многочисленные споры присутствуют в воздухе, особенно в конюшнях, сараях и помещениях для животных.Они широко распространены в окружающей среде и откладываются на шерсти и поверхности кожи животных [28].
В течение 10 лет среди мицелиальных грибов, выделенных при кожных инфекциях, было также Alternaria spp . Во многих лабораториях рост колоний Alternaria рассматривается как типичное заражение культур сапрофитными грибами, поскольку они широко распространены в окружающей среде и колонизируют различные растения или вызывают их заболевания [29]. Споры Alternaria присутствуют в воздухе, почве и воде или на поверхности кожи человека и животных [6, 11, 29]. Однако в ветеринарии инфекции, вызываемые плесенью, такой как Alternaria alternata , особенно у лошадей, а также гиперчувствительность, часто отмечаемая у домашних животных, стали новой клинической проблемой. Несмотря на то, что Alternaria не относится к кератинолитическим грибам, разрастание грибковых элементов, присутствующих в тканях, позволяет предположить, что они могут быть ответственны за повреждение кожи.Принимая во внимание возрастающее число случаев, когда этот гриб обнаруживается как единственный возбудитель кожных поражений [30], следует отметить, что растущий мицелий может механически повреждать соседние ткани. В нашей практике мы выделили грибов Alternaria в 13,8% положительных культур, и мы видели на микроскопических слайдах, приготовленных непосредственно из соскобов кожи, что пороконидии Alternaria смогли прорасти и произвести гиф в роговом слое. В Польше такие сообщения были редкими до 2013 года, когда Дворецка-Кашак [31] описал споры Alternaria , пролиферирующие в соскобах кожи, и выделил их как единственного возбудителя грибкового дерматита у лошади. В том же году Tyczkowska-Sieroń и Głowacka [32] описали дерматомикозы у двух шетландских пони и собаки бигль, у которых Alternaria tenuissima был этиологическим агентом. В международной ветеринарной литературе уже много лет описываются кожные грибковые гранулемы, встречающиеся у лошадей.Многие авторы отмечают случаи дерматита лошадей, при которых в образцах, полученных при биопсии кожных узелков, было обнаружено грибов Alternaria [30, 33, 34]. В некоторых клинических образцах этого исследования Alternaria был выделен как единственный инфекционный агент, вызывающий поражения кожи, характерные для дерматомикозов, как сообщалось ранее [30]. Alternaria alternata был зарегистрирован как распространенный комнатный аллерген, вызывающий различные реакции гиперчувствительности у людей, иногда приводящий к астме [29, 35, 36].Хотя серьезные инфекции у иммунокомпетентных хозяев встречаются редко. Этот грибок может вызывать оппортунистические инфекции у пациентов с ослабленным иммунитетом, особенно у тех, кто подвергается трансплантации солидного органа или костного мозга [36]. Грибы Alternaria spp. были также отмечены как возбудители глазных микозов и онихомикозов, связанных либо со стероидной терапией, либо с посттравматическими нарушениями [36]. Кроме того, их присутствие в продуктах питания (например, в зерновых, овощах, фруктах) очень распространено.
Наш анализ образцов, полученных от животных с клиническими симптомами дерматита, не выявил случаев инфекций, вызванных диморфными грибами, поскольку эти облигатные патогены являются эндемичными для других географических регионов. Несмотря на то, что были зарегистрированы клинические случаи гистоплазмоза в европейских странах (Австрия, Италия, Турция) [37, 38] или криптококкоза [20], представленное ретроспективное исследование подтвердило, что они обычно не обнаруживаются у домашних животных в Польше.
Помимо мицелиальных грибов, мы также сообщили о выделении рода Malassezia. Эти дрожжи обнаруживаются в различных участках кожи здоровой кожи человека [8], а также присутствуют на вересковой коже собак [6]. Традиционно считалось, что липид-зависимые виды встречаются только на коже человека, тогда как предполагалось, что M. pachydermatis ограничиваются кожей животных и, в частности, плотоядных [39]. Предполагается, что другие виды Malassezia , такие как M. globosa или M. sympodialis , или даже липид-зависимые штаммы M.pachydermatis могли быть вовлечены в развитие отита у собак, но мы не смогли их культивировать [40, 41]. Указанные виды были выделены также из кожи здоровых кошек [39, 42]. Хотя в большинстве случаев эти дрожжи имеют условно-патогенную природу, они могут стать патогенными при любых изменениях микробиоты кожи, нарушениях защитных механизмов хозяина или дисбалансе гомеостаза [39, 43,44,45]. Также дерматит, вызванный укусами блох, особенно когда он сопровождается реакцией гиперчувствительности, вместе с пищевой гиперчувствительностью или атопией, а также терапия антимикробными препаратами или кортикостероидами может способствовать размножению этих дрожжей [39].Кроме того, существуют породы собак с повышенным риском развития малассезиоза, например Вест-хайленд-уайт-терьеры, бассет-хаунды, гончие, спрингер-спаниели и кокер-спаниели или боксеры [39, 43,44,45]. У кошек инфекции Malassezia более ограничены и обычно связаны с другим основным или сопутствующим заболеванием, таким как ретро-вирусные инфекции [39]. Дрожжи Malassezia , особенно M. pachydermatis , также были выделены от диких ластоногих и хорьков, лисиц, медведей или других видов животных, таких как свиньи, лошади, а также от птиц.Они также были отмечены в литературе как этиологические агенты инфекций таких «экзотических» видов хозяев, как носороги, дромадеры, окапи или слоны [39]. M. pachydermatis по-прежнему является наиболее распространенным грибковым агентом, вызывающим внешний отит и другие типы дерматита у домашних животных, особенно у собак, что было описано другими и подтверждено в этом отчете [39, 44, 46, 47 , 48]. Мы выделили этот вид из более чем 80% положительных грибковых культур мазков из уха, взятых из случаев наружного отита, случаев.Наши наблюдения грибкового разнообразия в клинических образцах, полученных от собак с различной кожной гиперчувствительностью, также совпадают с экспериментами Мисон-Смит и ее группы [6]. Они показали, что Malassezia колонизация слуховых проходов собак-аллергиков была значительно более многочисленной, чем у здоровых людей [6]. На рис. 2а и б показаны препараты, полученные под прямым микроскопом, полученные из образцов, взятых из наружного слухового прохода двух разных собак, страдающих отитом наружного слуха. У одной собаки, как и у многих других, был идентифицирован наиболее частый этиологический агент — M. pachydermatis — , тогда как у второй особи мы обнаружили бластоспор M. globosa , что соответствовало литературным данным, показывающим наличие этого вида в слуховой проход собак. Эти условно-патогенные дрожжи приобретают все большее значение при заболеваниях человека и животных [8, 9, 49, 50]. Malassezia pachydermatis был описан как причина спорадических инфекций кровотока (BSI), особенно у новорожденных с низкой массой тела при рождении и у недоношенных детей.Большинство случаев грибкового ИМТ отмечается у пациентов с любыми внутривенными катетерами. Другими факторами, повышающими риск ИМТ, являются искусственная вентиляция легких и лечение стероидами и антибиотиками [49]. Случаи опасной для жизни фунгемии у людей были приписаны Malassezia pachydermatis , для которой собаки являются естественным хозяином. В некоторых случаях источники заражения человека связывают с домашними собаками, принадлежащими медицинским работникам [46, 47].
Некоторые дрожжи Candida , особенно C.albicans , являются эндогенными сапрофитами, но их роль в качестве условно-патогенных микроорганизмов также известна и описана. Вместе с Cryptococcus neoformans эти дрожжи являются одними из наиболее важных этиологических агентов оппортунистических системных микозов, особенно у пациентов с ослабленным иммунитетом, которые в противном случае не хотели бы заразиться.
Примеры заболеваний, связанных с иммуносупрессией, включают СПИД, изменение или перемещение нормальной микробиоты, вызванное антибиотиками, иммуносупрессивной терапией и метастатическим раком или тяжелыми хирургическими процедурами.У домашних животных частота системных микозов Candida не так высока, но роль этих дрожжей как возбудителя других микозов возросла. Медицинские состояния, повышающие предрасположенность животных, таких как собаки или кошки, к конфетдозу, на короткое время такие же, как и у людей, включая диабет, другие эндокринные нарушения и неопластические заболевания [21, 51]. Есть также предположения, что эти дрожжи могут играть роль в атопическом дерматите (БА) у людей, влияя на выработку IgE, но это до сих пор полностью не объяснено и не доказано [9].
В нашей микологической лаборатории. Candida дрожжи выделяют часто, в основном, из слизистых оболочек различных животных [21]. Мы также наблюдали их рост из мазков с кожи и соскобов или мазков из слухового прохода. За отчетный 10-летний период мы идентифицировали штаммов Candida , в основном C. albicans , в 27,1% положительных грибковых культур в случаях дерматита, и 19,8% положительных грибковых культур в случаях наружного отита, случаев. Среди прочего, C.krusei , C. glabrata или C. parapsilosis также были изолированы. В этом отчете мы также показали, что количество изолятов Candida , полученных от домашних животных, может быть сопоставимо или даже сравнимо с количеством изолятов Malassezia . Наши данные могут указывать на то, что грибы из рода Candida являются важными факторами дерматита у животных, в том числе у иммунокомпетентных особей.
Стригущий лишай (дерматофитоз) — Медицинская программа приюта в Мэдисоне Университета Висконсина
Содержание:
Введение
Диагностика стригущего лишая
Лечение стригущего лишая
Проверка излечения
Предотвращение распространения стригущего лишая в приюте
Лечение стригущего лишая в частном или приемном доме
Краткое изложение профилактики и лечения
Введение
Стригущий лишай у отдельного животного является неприятностью; однако стригущий лишай в приюте для животных может привести к совершенно неуправляемым вспышкам, тысячам долларов на диагностику и медицинские расходы, возможности распространения среди усыновителей и персонала, а также к недопустимому удару по статусу приюта в обществе.Жизненно важно иметь последовательную и эффективную стратегию профилактики и лечения этого заболевания.
Что такое стригущий лишай?
Стригущий лишай, или «дерматофитоз», представляет собой грибковую инфекцию, поражающую кожу, волосы и иногда ногти животных (и людей). Три вида стригущего лишая чаще всего поражают кошек и собак:
У кого стригущий лишай?
Виды дерматофитов, поражающие кошек и собак, могут передаваться между этими двумя видами, а также между людьми и другими млекопитающими.
Факторы, повышающие риск стригущего лишая
- Возраст — Восприимчивы животные любого возраста, но молодые животные (<1 года) и гериатрические животные подвергаются наибольшему риску
- Виды и породы — Кошки подвергаются большему риску, чем собаки. Персидские кошки и йоркширские терьеры относятся к группе относительно высокого риска, как и длинношерстные кошки в целом.
- Иммунный статус — Состояния, подрывающие иммунную систему, такие как FIV, FeLV, беременность / лактация, недоедание, противовоспалительные препараты, рак или стресс
- Ранее существовавшие условия — Животные с уже существующими условиями, которые затрудняют уход за шерстью (например,грамм. URI) или целостность кожи (например, аллергия на блох, чрезмерный уход, внешние паразиты) подвергаются повышенному риску
Как передается стригущий лишай?
M. canis чаще всего передается при контакте с инфицированным животным или в загрязненной окружающей среде, и поэтому с наибольшей вероятностью представляет собой серьезную проблему в приюте. Считается, что T. mentagrophytes заразился в основном в результате контакта с гнездами грызунов, а M. gypseum — из загрязненной почвы, хотя существует возможность передачи от животного к животному в загрязненной окружающей среде.
Стригущий лишай очень устойчив в окружающей среде. Стригущий лишай может сохраняться на любой поверхности и может инфицировать животных, содержащихся в загрязненной среде, спустя месяцы и даже годы. (См. Информацию по очистке окружающей среды, чтобы узнать больше об определении источников значительного загрязнения.)
Стригущий лишай может легко передаваться через инвентарь для ухода, зараженные игрушки и постельные принадлежности, а также через одежду и руки людей. В природе инкубационный период стригущего лишая составляет от 4 дней до 4 недель.Стригущий лишай можно найти на шерсти животных из загрязненной среды, даже если само животное не проявляет никаких признаков.
Клинический вид
Название «стригущий лишай» происходит от наиболее частого появления круглой области выпадения и шелушения волос. Чаще всего встречаются морда, уши, лапы и хвост. Однако стригущий лишай может проявляться по-разному, включая выпадение волос на больших участках с корками и экссудатом или без них. Стригущий лишай также может вызвать инфекцию ногтей на ногах и ногтевого ложа.Поражения стригущего лишая могут быть или не быть зудящими (зудящими).
Существуют и другие возможные причины всех типов поражений, описанных выше, поэтому окончательный диагноз, основанный только на внешнем виде, невозможен. Не все области облысения вызваны стригущим лишаем. Обычно также наблюдаются признаки воспаления — покраснение кожи, отек, тепло на ощупь, зуд или болезненность. В исследовании, проведенном в приюте, большинство кошек с кожными поражениями не были инфицированы стригущим лишаем, И у значительного числа кошек без явно выраженных повреждений посевы были положительными.Таким образом, в идеале для подтверждения или исключения стригущего лишая у всех кошек, особенно у тех из группы повышенного риска из-за наличия кожных заболеваний, породы или риска воздействия (см. Ниже), следует использовать культуру грибов. Наиболее распространенные дифференциальные диагнозы облысения, которые следует учитывать, включают демодекозная чесотка и стафилококковый фолликулит.
Диагностика стригущего лишая
Точный диагноз стригущего лишая очень важен: последствия ложноположительного теста могут быть серьезными для отдельного диагностированного животного, особенно в агентствах, которые усыпляют животных с положительным стригущим лишаем.Последствия ложноотрицательного результата также значительны, так как он может позволить инфицированному человеку распространить стригущий лишай внутри учреждения или в приемную или приемную семью. К сожалению, не существует быстрого и надежного теста для диагностики стригущего лишая. Есть способы подтвердить его присутствие, но нет окончательного способа подтвердить его отсутствие, кроме тщательного посева грибков и микроскопического исследования.
Если по практическим соображениям необходимо сделать «наилучшее предположение» без проведения грибковой культуры, анамнез животного, клинические признаки и результаты обследования с помощью лампы Вуда следует рассматривать вместе.Например, классическое кольцевидное поражение у котенка, особенно если поражено несколько членов помета, с большой вероятностью будет стригущим лишаем, даже если результаты лампы Вуда будут отрицательными. С другой стороны, стригущий лишай редко встречается у взрослых собак, поэтому даже подозрительное поражение с большей вероятностью будет иметь другую причину, если нет сильно подозрительного анамнеза (т.
Недавно (март 2015 г.) IDEXX Laboratories представила методику Ringworm ReaPCR ™ для диагностики стригущего лишая.Исходя из нашего опыта, у всех подозреваемых животных все же необходимо провести посев для подтверждения наличия или отсутствия грибка.
Лампа Вуда
Лампа Вуда — это ультрафиолетовый свет с определенной длиной волны света, который вызывает флуоресценцию некоторых штаммов M. canis (наиболее распространенного вида стригущего лишая у кошек). Лампа Вуда при правильном использовании может быть полезным и экономичным инструментом для проверки. Традиционно сообщалось, что 50% из штаммов M. canis будут флуоресцировать под лампой Вуда.Однако некоторые люди сообщают, что более 90% из штаммов M. canis будут флуоресцировать. Яркая яблочно-зеленая флуоресценция, покрывающая стержни волос, явно указывает на инфекцию и требует изоляции и культивирования грибов.
Ложноположительные результаты лампы Вуда — обычное дело, особенно когда тест проводится нетренированным или неопытным персоналом. Некоторые лекарства, в том числе доксициклин, клавамокс и глазные мази, будут флуоресцировать, если они попадут на шерсть. Кожный жир может светиться желтым, и его не следует принимать за инфекцию стригущего лишая.
Флуоресценцию, вызванную инфекцией M. canis , можно отличить от флуоресценции, вызванной загрязнителями, по тому факту, что стригущий лишай не может быть легко счищен щеткой, а сами стержни волос будут флуоресцировать характерного зеленого цвета яблока, а не большой площади кожи, как это было бы быть замеченным с лекарством в шерсти. Наблюдение за известными поражениями поможет развить навыки распознавания истинной флуоресценции.
Чтобы получить максимальную пользу от этого теста, важно правильно использовать правильное оборудование:
- Следует использовать настоящую лампу Вуда, а не обычную УФ-лампу, поскольку лампы Вуда флуоресцируют на определенной длине волны (360 нм).
- Подключаемый модуль, а не модель батареи, идеален, поскольку более сильный свет с большей вероятностью вызывает флуоресценцию
- Выполните исследование в полностью темной комнате и дайте глазам привыкнуть перед выполнением исследования
- Держите лампу на расстоянии не более 4-10 см от животного
- Внимательно осмотрите животное, особенно на морду, лапы, живот и внутри ушей
- Ниже приведено отличное видео о том, как пройти тщательный экзамен по лампе Вуда.
Хотя отсутствие флуоресценции лампы Вуда никоим образом не исключает заражения стригущим лишаем, положительный результат является хорошим индикатором, по крайней мере, для изоляции животного до определения результатов культивирования грибка.
Прямое микроскопическое исследование
Положительные результаты исследования лампы Вуда и прямое микроскопическое исследование могут диагностировать стригущий лишай, но отрицательные результаты не исключают этого. Прямое микроскопическое исследование используется для подтверждения результатов испытаний ламп Вуда и может быть особенно полезно, если результаты испытаний ламп Вуда неоднозначны. Результаты можно улучшить с помощью практики.
Положительные волосы лампыIndividual Wood’s можно осторожно выдернуть из волосяного фолликула и поместить в каплю минерального масла для непосредственного исследования.Некоторые люди рекомендуют очистить образец от кератина, суспендировав его в 10-20% КОН или хлорфенолаке перед исследованием, но мы не сочли этот шаг необходимым, и эти вещества разъедают линзы микроскопа.
Зараженные волосы выглядят опухшими, потрепанными, имеют неправильные или нечеткие очертания, а нормальная структура кутикулы, коры и продолговатого мозга теряется.
Распознавание пораженных волос требует практики. Чтобы получить опыт постановки диагноза с помощью этого метода, исследуйте известные инфицированные волосы из очага поражения лампой Вуда в сочетании с результатами посева от того же человека.Сомнительные случаи или противоречивые результаты лампы Вуда и прямого осмотра следует культивировать. Решение о культивировании образцов может зависеть от протокола приюта в отношении лечения или эвтаназии животных с положительным стригущим лишаем и уверенности персонала в оценке лампы Вуда и прямом микроскопическом исследовании волос.
Грибковая культура
Хотя золотым стандартом диагностики стригущего лишая остается положительное определение спор, возникших в результате роста на грибковой культуре, тест с лампой Вуда и прямое микроскопическое исследование в руках опытного специалиста могут быть использованы в качестве подтверждения инфекции.Грибковая культура остается важным инструментом для получения несогласованных результатов, неопытного персонала, а также для мониторинга лечения и ведения.
Проведение тестирования грибковых культур на месте, где это возможно, по сравнению с отправкой в диагностическую лабораторию, имеет несколько преимуществ. Чтобы правильно управлять вспышкой стригущего лишая, поражающей несколько животных, часто требуется большое количество культур. Посевы следует проводить для оценки риска у подвергшихся воздействию кошек, диагностики подозрительных поражений и подтверждения излечения после лечения.Это может быстро стать непомерно высокими расходами, если культивирование не будет рентабельным.
Самостоятельное считывание посевов также позволяет быстрее диагностировать положительные результаты, поскольку рост часто происходит в течение недели, что позволяет раньше начать лечение. Количество роста на культуральной пластине может помочь отличить возможных носителей от действительно инфицированных животных.
Приемные родители могут быть проинструктированы о правильной технике сбора культур с зубной щетки и могут просто приносить образцы для постоянного мониторинга, а не каждый раз приносить всех инфицированных животных.
Заметки об успешном культивировании стригущего лишая
Пластинчатые культуры легче засеять с помощью зубной щетки, чем из узких банок или скошенных банок. Из них также легче собирать образцы для микроскопического исследования. Чашки, которые объединяют тестовую среду дерматофитов на одной стороне, чтобы дать изменение красного цвета с большинством видов дерматофитов со средой для быстрого спорулирования или агаром Сабуро с декстрозой, чтобы помочь в микроскопической идентификации колоний на другой стороне, являются идеальными. Таблички можно заказать в Hardy Diagnostics.
Для одиночных поражений:
- Выщипайте большое количество отдельных волосков с помощью кровоостанавливающего зажима или руки в перчатке от подозрительных поражений (если волосы положительны с помощью лампы Вуда, выберите их)
- Плотно прижмите волосы к культуре
- Даже для животных с поражениями может быть предпочтительнее культивирование с помощью зубной щетки, как описано ниже.
Для животных без повреждений или мультифокальных поражений (культура зубной щетки):
- Если есть подозрение на заражение шерсти, протрите животное влажной тканью перед посевом
- Используя зубную щетку из только что открытой упаковки, почистите животное не менее 30 раз, включая вокруг лица, внутри и снаружи ушных раковин, а также вокруг ногтевого ложа.Подозрительные области должны быть последними.
- Если зубные щетки транспортируются до посева культур, убедитесь, что они не подвергаются воздействию высоких температур (например, в горячей машине), так как это может уничтожить споры и привести к ложноотрицательным результатам посева.
- При посеве убедитесь, что питательная среда имеет комнатную температуру
- Плотно прижмите зубную щетку к питательной среде, но не так сильно, чтобы питательная среда не разрушилась
- Не забудьте пометить образец датой и идентификатором животного
- Поддерживайте культуру при температуре от 75 до 80 градусов по Фаренгейту (Если в приюте нет удобного инкубатора, сделайте импровизированный инкубатор, используя лампочку и термометр в закрытом пластиковом контейнере.Поместите в инкубатор емкость с водой, чтобы предотвратить обезвоживание питательной среды.)
- Ежедневно проверяйте посевы для отслеживания роста. В подавляющем большинстве случаев M. canis у необработанных животных вырастет в течение 10 дней, но на всякий случай чашки следует выдержать в течение 21 дня (для роста видов Trichophyton может потребоваться больше времени). Хотя доступны наборы для культивирования, которые, как утверждается, дают результаты менее чем за 10 дней, они не являются надежными.
- Всегда подтверждайте вид микроскопически — некоторые непатогенные грибы невооруженным глазом могут выглядеть как стригущий лишай.У видов стригущего лишая будет развиваться рост колоний одновременно с изменением цвета среды. Кроме того, стригущий лишай имеет характерный белый пушистый вид колонии, тогда как другие виды грибов часто бывают желтыми, зелеными или слизистыми.
Идентификационный номер
Не все дерматофиты окрашивают тестовую среду дерматофитов в красный цвет, поэтому возможны ложноотрицательные результаты. Некоторые другие типы непатогенных грибов могут вызывать красный цвет, поэтому возможны ложные срабатывания.Чтобы быть уверенным в диагнозе стригущего лишая, необходимо провести микроскопическое исследование и точно идентифицировать грибок. Культуру на среде с быстрым спорулированием можно исследовать под микроскопом, чтобы точно идентифицировать присутствующий гриб.
Это достигается путем микроскопического исследования «препарирования ленты»:
- Нанесите каплю красителя лактофенолового синего на предметное стекло
- Приклейте липкую сторону куска ленты на подозрительную колонию
- Поместите ленту на каплю пятна и исследуйте под микроскопом
Большинство наборов питательных сред поставляется с руководством по микроскопической идентификации.Описания и фотографии для идентификации грибков можно найти в «Дерматологии мелких животных» Мюллера и Кирка, 7-е издание (Сондерс), глава 2, «Методы диагностики».
Лечение стригущего лишая
В большинстве случаев домашние животные спонтанно выздоравливают от стригущего лишая в течение примерно 3 месяцев. Ожидание самолечения — это, безусловно, разумный выбор в семье с одним животным, где нет маленьких детей или взрослых с ослабленным иммунитетом, где заражение не является серьезной проблемой. Однако в условиях приюта или приюта очень желательно более быстрое разрешение.Снижение загрязнения окружающей среды так же важно, как и лечение, направленное на ускорение выздоровления пораженных животных.
Стрижка и бритье
Стрижка кошек с короткой и средней шерстью часто не требуется, и она может усугубить поражение из-за микротравм и механического распространения спор. Тем не менее, стрижка показана для очень длинношерстных кошек и кошек, которые могут быть не в состоянии ухаживать из-за экстерьера (например, персы), одновременной тяжелой заложенности верхних дыхательных путей или спутанной шерсти.Стрижка также может быть полезна для кошек, у которых шерсть становится непослушной после окунания.
Стрижку следует выполнять осторожно с помощью лезвия №10 — очень осторожно, чтобы не обжечься машинкой для стрижки, — а волосы следует тщательно утилизировать. Стрижка более близким лезвием вызывает чрезмерную травму и увеличивает вероятность обострения повреждений. Стрижка должна выполняться в комнате, которую легко чистить, поскольку она вызывает сильное загрязнение окружающей среды (см. Ниже), а используемые инструменты следует тщательно очищать и использовать только для этой цели, никогда не использовать на здоровых животных (т.е. не используйте хирургические машинки для стригущего лишая кошек!).
Важно носить защитную одежду при работе со стригущим лишаем животного в приюте, особенно при стрижке. В учреждении с легко очищаемой / дезинфицируемой комнатой для эвтаназии это может быть хорошим местом для стрижки кошек с стригущим лишаем.
Местное лечение
Самым важным компонентом лечения населения является местная терапия.
Это очень важно для уменьшения непосредственного и постоянного загрязнения окружающей среды.Лучше всего это достигается с помощью местной терапии, которая стерилизует шерсть и предотвращает дальнейший рост спор, которые могут повторно загрязнить окружающую среду.
Из всех доступных местных методов лечения раствор извести и серы является наиболее экономически эффективным, поскольку он стерилизует шерсть, чтобы предотвратить дальнейший рост стригущего лишая, его относительно легко быстро применить к нескольким кошкам и было документально подтверждено, что он хорошо работает в условиях приюта .
Шампунь Miconazole в сочетании с хлоргексидином также может быть эффективным; одного хлоргексидина нет.Раствор энилконазола, хотя, как сообщается, эффективен, недоступен для этого использования в Соединенных Штатах (он регулируется EPA, а не FDA, которое не разрешает использование не по назначению таким же образом). Некоторые доступные в настоящее время местные методы лечения неэффективны или эффективны лишь частично; соблюдайте осторожность при выборе другой обработки, кроме раствора серной извести. Шампуни с хлоргексидином и местные мази для местного применения не обеспечивают эффективной стерилизации шерсти и не обеспечивают остаточную активность против дальнейшего роста. Тербинафин (Ламизил) и клотримазол (Лотримин) для местного применения не рекомендуются для применения у домашних животных, поскольку они не замедляют дальнейший рост поражений стригущего лишая.
ШампуньPure Oxygen® (шампунь с ускоренной перекисью водорода от Ogena Solutions) может удалить споры стригущего лишая с шерсти. Продолжаются исследования, чтобы определить эффективность шампуня Pure Oxygen® в качестве местного средства от стригущего лишая.
Использование серы извести:
- Используйте 8% концентрацию (примечание: это 8 унций на галлон теплой воды, что вдвое превышает рекомендуемую концентрацию, указанную на бутылке)
- Применять два раза в неделю на протяжении всего лечения
- Безопасен для беременных и кормящих животных, а также котят / щенков старше 2–3 недель
- Протрите соски кормящих мам после местного лечения, согрейте молодых людей с помощью нагревательной лампы или нагревательных блоков, если необходимо
- Электронный ошейник после этого не нужен
- Не мочить животное заранее
- Рассмотрите возможность использования нового садового опрыскивателя для нанесения: подробности можно найти на веб-странице по лечению дерматофитов Гуманного общества округа Дейн.Обязательно держите конец распылителя близко к коже животного при нанесении.
- Нанесите раствор на лицо, нос и уши с помощью небольшой тряпки или губки.
- Использование офтальмологической мази для защиты глаз кошки не рекомендуется, потому что, если раствор попадет в глаз, может быть очень трудно удалить раствор, если он смешан со смазкой. Вместо этого держите глаза под рукой и щедро промывайте, если раствор попадет в кошачий глаз.
- Не промывать животное после нанесения раствора; оберните животное полотенцем и дайте высохнуть
Обратите внимание: физически окунать кошек в известково-серный раствор не рекомендуется, поскольку это вызывает стресс для кошек (и персонала) и может привести к перекрестному заражению между кошками, которых лечат, если один и тот же раствор известковой серы используется несколько раз кошки.
Системное лечение
Системное лечение является важным дополнением к местной терапии, особенно в приюте, где время до излечения является важным фактором. Длительное пребывание в приюте или приемной семье увеличивает вероятность распространения, использует драгоценное изолированное пространство и может снизить адаптивность пациента, особенно если котятам позволено стареть во время лечения.
Недостатками системного лечения являются относительно высокая стоимость препаратов и возможность развития токсических побочных эффектов.Итраконазол — хороший выбор из-за его продемонстрированной эффективности, относительной безопасности и длительного периода полувыведения из кожи. Мы не рекомендуем комбинированный итраконазол, поскольку неоднократно доказывалось, что он менее эффективен и может привести к неэффективности лечения.
Сообщается также, чтоэффективны флуконазол и тербинафин. Гризеофульвин эффективен, но с большей вероятностью, чем итраконазол, вызывает токсические побочные эффекты. По возможности следует избегать применения кетоконазола у кошек, поскольку он может вызвать гепатотоксичность у этого вида.В повторных исследованиях было показано, что луфенурон (программа) является неэффективным .
Животные, принимающие любые системные противогрибковые препараты, должны находиться под тщательным наблюдением и тщательно следовать всем инструкциям по применению препаратов. Эти препараты следует избегать беременным животным.
Процедуры, которые не работают
, аНесмотря на то, что многие виды лечения, как сообщается, эффективны для отдельных животных, частота самолечения затрудняет оценку этих утверждений в отсутствие подтверждающих научных данных.В условиях популяции неэффективность лечения более очевидна и распространена, и требования к высокоэффективному лечению являются строгими. Следующие методы лечения не продемонстрировали свою эффективность в контролируемых исследованиях:
- Луфенурон (Программа)
- Кремы и мази для местного применения
- Хлоргексидин в качестве шампуня или дезинфицирующего средства
- Пероксимоносульфат калия (Trifectant) в виде капли
«Натуральные» методы лечения, часто предлагаемые на сайтах с хорошими намерениями, такие как яблочный уксус, кокосовое масло, масло чайного дерева, папайя, чеснок, экстракт семян грейпфрута, коллоидное серебро, бетадин и местные отбеливатели, неэффективны, а некоторые из них домашние средства токсичны для домашних животных.
Импульсная терапия сложна, и ее трудно отслеживать в условиях приюта. Это требует ударной дозы и в конечном итоге не снижает количество лекарства, используемого для лечения. Поэтому пульс-терапия не рекомендуется.
Проверка излечения
Крайне важно понимать, что животные все еще могут быть носителями инфекционных грибов даже после того, как признаки полностью исчезли. Животные могут считаться вылеченными после отрицательного результата 3 последовательных еженедельных посева грибов.(Если два раза в неделю используются известковая сера и системный итраконазол, может быть достаточно 2 культур.)
Посев на грибок должен быть получен методом сбора зубной щетки, начиная с 1 недели лечения. Животные, содержащиеся в загрязненной среде, могут случайно заразиться. Если это вызывает беспокойство, животное следует держать в чистой клетке или комнате в течение 5-10 дней до получения культуры.
Поскольку грибковые культуры требуют около двух недель для подтверждения отрицательных результатов, это означает, что лечение и документирование излечения займут как минимум 6-8 недель и может занять до 3-4 месяцев.Содержание и социализация животного в этот период являются чрезвычайно важными факторами при принятии решения о целесообразности лечения в приюте.
Предотвращение распространения стригущего лишая в приюте
В настоящее время нет вакцины, защищающей от стригущего лишая.
Лучшая защита, как и от многих инфекционных заболеваний, — это отличное содержание. Котят, которые подвергаются наибольшему риску, необходимо обследовать с помощью лампы Вуда и внимательно осмотреть их при поступлении и перед отправкой в приемные семьи.
Помните, что некоторые случаи не могут быть обнаружены с лампой Вуда. Для районов с высоким уровнем стригущего лишая всех котят или пометы следует содержать отдельно в легко дезинфицируемом помещении в течение не менее двух недель и наблюдать, прежде чем им будет разрешено бегать по птичнику (напомним, что инкубационный период составляет от 4 дней до 4 недель. , поэтому этот карантин отразит некоторые, но не все случаи).
Определить пораженных животных
- Тщательно осмотрите всех поступающих животных и всех животных, рассматриваемых для размещения в приемных семьях или группового содержания.Ищите любые участки с выпадением волос, струпьями или корками, особенно очаговые участки на лице, ушах, ступнях или хвосте
- Выполните обследование с помощью лампы Вуда для выявления всех подозрительных поражений и всех кошек, рассматриваемых для помещения в групповое жилье или приемных семей. Используйте правильную технику и осознайте ограничения этого экзамена (возможны ложноотрицательные результаты)
- Прямое микроскопическое исследование волос из подозрительных участков. Практикуйте технику и признайте ограничения (возможны ложноотрицательные результаты).
- Посев на грибок и идентификация под микроскопом во всех случаях, когда требуется окончательный диагноз
Отделить пораженных животных от общей популяции
Изолируйте пораженных или подозреваемых животных и установите протоколы очистки, чтобы предотвратить дальнейшее распространение. Нет необходимости полностью изолировать подозрительных или инфицированных животных в отдельном здании, если начата соответствующая очистка окружающей среды.
- Все поверхности, с которыми контактировали животные с подозрением на стригущий лишай, следует немедленно очистить, а затем продезинфицировать.Сюда входят полы, переноски, транспортные средства и столешницы.
- Четко идентифицируйте подозрительных животных (например, повесьте табличку на их клетке)
- Размещение пораженных и подозреваемых животных по отдельности в клетках, которые можно легко очистить, упростит идентификацию лечения, но во многих случаях преимущества социализации требуют совместного содержания котят или связанных пар в течение периода лечения. После отъема большие пометы следует разделить на несколько групп содержания (по 2-3 на клетку).
- При приеме на воспитание, содержание в большой клетке для собак или в легко очищаемой комнате, например в ванной, до тех пор, пока не будет завершено не менее двух недель эффективного местного лечения
- В идеале, подозреваемых на стригущий лишай следует держать отдельно от других животных. Если это невозможно, по крайней мере, держите их отдельно от групп высокого риска (котят, беременных мам, кошек с URI)
- Надевайте защитную одежду при работе в помещении для карантина стригущего лишая или при работе с пораженными животными (халат с длинными рукавами, перчатки, бахилы или ботинки, используемые только для этой цели).Выбрасывайте или стирайте защитную одежду ежедневно.
- Дезинфицируйте клетки и все поверхности в комнате дважды в неделю разбавленным отбеливателем (1:32) на чистой поверхности или Accel® (1:16). Чистку пятен следует проводить ежедневно, чтобы свести к минимуму неудобства и стресс для кошек.
- Посуду и другие предметы, которые можно мыть, можно мыть в посудомоечной машине при температуре воды не ниже 43,3 o C (110 o F)
- Постельное белье следует стирать в случае загрязнения или в дни, когда применяется местное лечение.Не переполняйте стиральную машину, так как это снижает ее способность механически удалять споры стригущего лишая. Белье от стригущего лишая следует стирать отдельно от другого белья. Сушите белье от стригущего лишая отдельно и очищайте фильтры для ворса после каждого использования. Постельное белье или игрушки, которые нельзя стирать, следует выбросить.
- После содержания животного, страдающего стригущим лишаем, тщательно очистите и продезинфицируйте клетку перед использованием клетки для другого животного (см. Протокол ниже)
- Тщательно очистите все участки, которые нельзя продезинфицировать, с помощью влажной швабры или электростатического очистителя, например Swiffer®, а затем пропылесосьте.Выбросьте мешок для пылесоса.
Обеззараживание окружающей среды
Основой дезактивации окружающей среды является идентификация, удаление и обработка (если в приюте есть соответствующее жилье / пространство и ресурсы) затронутых животных в сочетании с тщательной механической очисткой. Дезинфекция — важная часть протокола, но она является дополнением к механическому удалению.
Трижды очистите все поверхности любым хорошим моющим средством и чистой ветошью. После этого механического удаления используйте дезинфицирующее средство.Концентрированный отбеливатель или даже разбавленный в соотношении 1:10 слишком агрессивен для повседневного использования и, к счастью, в нем нет необходимости. К эффективным дезинфицирующим средствам относятся Accel® (ускоренная перекись водорода 1:16), Accel® TB (перекись водорода 0,5%), энилконазол, отбеливатель в соотношении 1:32 с увеличенным временем контакта (не менее 10 минут), 2% пероксимоносульфат калия, формула 409. ® (четвертичный аммоний 0,3%) и Clorox Clean-Up® (гипохлорит натрия 1,84%). Все они оказались очень эффективными на предварительно очищенных поверхностях, где были удалены все органические вещества.Для получения дополнительной конкретной информации об эффективности различных чистящих составов против спор стригущего лишая, см. Это исследование 2013 года в Veterinary Dermatology.
Высокая температура (> 110 градусов) также эффективна. Этой температуры можно достичь с помощью коммерческих посудомоечных машин, некоторых промышленных паровых аппликаторов (но не обязательно домашних паровых средств для чистки ковров) и сушилок для одежды.
Средство лечения окружающей среды: 5 D
Обеззараживание окружающей среды обычно несложно в типичном убежище с легко дезинфицируемыми и механически очищаемыми клетками.Это может представлять гораздо большую проблему в доме или в более домашней среде, такой как групповая кошачья комната.
Нанесение агрессивных дезинфицирующих средств на каждую загрязненную поверхность — невозможная цель в такой среде. К счастью, многого можно добиться путем выявления, удаления и лечения животных-носителей с последующим повторным нанесением смазки для локтей.
Грибковые культуры из окружающей среды могут избавить от догадок при дезактивации и избавить от лишней работы и беспокойства.Сначала тщательно очистите и продезинфицируйте, где это возможно, затем возьмите посевы из возможно зараженных участков, чтобы оценить успех (см. Ниже метод мазка Свиффера). Если посев отрицательный, то это место, вероятно, можно безопасно снова открыть для кошачьих обитателей. Если положительный результат, по крайней мере, вы точно знаете, что вам нужно вернуться и попробовать еще раз. Это поможет избежать мучений при замене ковров, мебели и т. Д. Пять рекомендаций по обеззараживанию стригущего лишая:
- Диагностировать
- Выявление и лечение инфицированных животных и животных-носителей.Никакая очистка или дезинфекция не сработают, если одно или несколько животных повторно загрязняют окружающую среду.
- Не забудьте проверить других домашних животных в приюте, особенно кошек.
- Поражения человека также необходимо идентифицировать и лечить.
- Выбросить
- Сильно открытые предметы, такие как когтеточки, которые нельзя легко мыть или дезинфицировать, следует выбросить
- Debulk
- Тщательная механическая очистка имеет большое значение для удаления стригущего лишая
- Это включает в себя очистку загроможденных поверхностей, использование средства для электростатической очистки, такого как Swiffer®, для удаления как можно большего количества пыли и волос с каждой поверхности, а также уборку всех доступных областей пылесосом.
- Промышленная паровая очистка ковров может быть полезна как для механической очистки, так и для термического уничтожения спор.
- По возможности, фильтры печи и вентиляционные отверстия следует очистить и / или заменить. Однако в чистке воздуховодов часто нет необходимости.
- Дезинфекция
- После удаления органических веществ (трижды с помощью моющего средства и чистой тряпки) используйте эффективное дезинфицирующее средство, такое как Accel® 1:16, Accel® TB (перекись водорода 0.5%), энилконазол, отбеливатель в разведении 1:32, 2% пероксимоносульфат калия, Formula 409® (четвертичный аммоний 0,3%) или Clorox Clean-Up® (гипохлорит натрия 1,84%).
- Документируйте успех через экологическую культуру
- Разрежьте Swiffer® на небольшие части, протрите возможно загрязненные поверхности до видимого загрязнения
- Несколько раз нажмите Swiffer® на чашку для культивирования грибов, затем культивируйте как обычно
- При необходимости повторяйте пять D, пока экологические культуры не станут отрицательными!
Какие процедуры необходимо выполнить в случае вспышки в приюте для животных?
Оценка риска для животных, подвергшихся воздействию
Когда у любого животного из популяции диагностируется стригущий лишай, возникает вопрос: что вы делаете с другими животными в окружающей среде? Все ли их нужно культивировать? Должны ли они все быть изолированы в ожидании результатов культивирования? Все ли они нуждаются в лечении?
Ответы на эти вопросы зависят от нескольких факторов.Не все животные в одном доме или даже в одной комнате с животными, инфицированными стригущим лишаем, заразятся сами. Риск заражения зависит от индивидуального иммунного статуса животного и его привычек к уходу, общей чистоты окружающей среды и степени близости между зараженными и инфицированными животными. Вот некоторые вопросы, которые следует задать:
Каков базовый уровень санитарии? Это хорошо очищаемая среда, например, группа клеток из нержавеющей стали в пустой комнате? Это дом с множеством когтеточек, мебелью и ковровым покрытием для сбора спор? Где-то посередине, например, ряд клеток в грязной комнате, где валяется много всякого хлама? Используется ли отбеливатель или Accel для дезинфекции на регулярной основе?
Насколько близко были облучены животные? Были ли они все в отдельных клетках с минимальным обращением со стороны персонала, которое могло переносить инфекцию на их одежде? Было ли какое-то общее пространство, такое как зона для упражнений или «комната для знакомств», где животные собираются вместе или проводят время без уборки между обитателями? Разрешено ли кошкам свободно бродить во время уборки, но в противном случае они содержатся отдельно?
Есть ли доказательства распространения? Пострадало более одного животного? Все ли затронутые кошки из одной зоны приюта, или он обнаружился более чем в одной комнате? Пострадали ли животные, которые находились в приюте длительное время (> 2-4 недель)? (Это говорит о заражении в приюте, а не о попадании в уже инфицированный.)
Если окружающая среда в основном чистая, животные, как правило, содержатся в разумных пределах и общее состояние здоровья животных хорошее, животные нередко выживают при незначительном воздействии, не заразившись. В идеале, всех подвергшихся воздействию животных следует выращивать с помощью зубной щетки, но это часто непрактично и может не понадобиться в достаточно хорошо управляемом приюте.
С другой стороны, посевы зубных щеток обычно требуются в приемных семьях, где есть широкие возможности для контакта, в приюте для кошек без клеток или в групповой комнате для кошек, или в любое время, когда есть доказательства значительного распространения (поражено несколько кошек). ).Для получения дополнительной информации об интерпретации грибковых культур («оценка патогенов») и управлении на основе результатов культивирования, пожалуйста, посетите https://www.giveshelter.org/dermatophyte-treatment-in-a-nutshell.html.
В случае настоящей вспышки многие приюты сочтут невозможным прекратить прием на время лечения. В таких случаях необходимо создать чистую отдельную зону для новых приходящих кошек. Если это невозможно, однократное погружение в известковую серу при приеме внутрь может снизить вероятность заражения, если кошек необходимо поместить в загрязненную среду.
Как всегда, предотвращение вспышки инфекционного заболевания намного дешевле и проще для всех, чем борьба со вспышкой. После вспышки любого рода весь персонал должен встретиться, чтобы убедиться, что все сотрудники и волонтеры понимают, как возникла ситуация и какие методы контроля были наиболее эффективными для прекращения вспышки. На основе этой информационной встречи должен быть разработан, разработан план предотвращения вспышек в будущем, записано , опубликовано и распространено , чтобы все участники знали о своей роли в предотвращении будущих вспышек.
Лечение стригущего лишая в приемной семье или частном доме
Ежедневная уборка минимизирует загрязнение окружающей среды, которое накапливается во время содержания пораженных животных. Кроме того, после того, как пораженные животные покинули окружающую среду (или выздоровели), потребуется тщательная очистка. Это будет намного проще, если животные будут находиться в небольшом помещении дома с минимальным количеством мебели и ковров (например, большая клетка для собак, ванная комната). Это особенно важно до тех пор, пока не будут завершены первые две недели эффективного местного лечения, а в идеале — пока не будет получена по крайней мере одна отрицательная культура грибка.
Очистка домашней обстановки в случае заражения стригущим лишаем:
Ежедневно
- Все непористые поверхности следует протереть влажной шваброй, Swiffer® и / или пропылесосить (для сбора инфекционных волос) и продезинфицировать с помощью отбеливателя или Accel. Сюда входят полы, стены, столешницы, подоконники и держатели.
- Коврики следует пылесосить два раза в день. Пакеты для пылесосов следует регулярно выбрасывать.
- Постельное белье и защитную одежду следует менять ежедневно, стирать отдельно в горячей воде с четвертью стакана отбеливателя и сушить в сушилке (или выбрасывать)
После удаления пораженных животных выполните пять шагов D, как описано выше.Степень необходимости обширной очистки зависит от уровня загрязнения окружающей среды. Если котята возились по дому в течение некоторого времени до постановки диагноза или если эффективное местное лечение не применялось постоянно, могут потребоваться значительные усилия. С другой стороны, если кошку содержали в разумных пределах на очищаемой территории и эффективно обрабатывали извне, базовой очистки может быть достаточно.
Некоторые шаги, которые следует учитывать, включают:
- Все животные, подвергшиеся воздействию, должны быть проверены на стригущий лишай, как описано выше, чтобы убедиться, что у них нет субклинических поражений
- Все открытые постельные принадлежности, игрушки, щетки и т. Д.следует постирать / высушить или выбросить
- Все непористые поверхности следует тщательно очистить и продезинфицировать, если возможно, с помощью отбеливателя (разведение 1:32) или Accel®. Это следует повторить не менее двух раз. Если используется отбеливатель, его необходимо нанести на предварительно очищенную поверхность и смыть после достаточного времени контакта (не менее 10 минут влажного контакта).
- Все открытые ковры и мебель следует пылесосить ежедневно в течение одной недели, а мешки для пылесоса выбрасывать ежедневно.
- Необходимо пропылесосить все вентиляционные отверстия для обогрева и охлаждения или заменить фильтры.Обычно нет необходимости в промышленной чистке воздуховодов.
- Ковры следует чистить паром в промышленных условиях. Очистка паром моющими средствами, использующими горячую водопроводную воду, неэффективна, так как вода не достигает достаточно высокой температуры.
- Одежду, которую носили при контакте с кошками, следует постирать в горячей воде с отбеливателем, затем высушить в сушилке или повесить на солнце.
- Необходимо провести экологические посевы для проверки успешности дезактивации перед повторным открытием приемного дома для новых животных
Краткое изложение профилактики стригущего лишая
- Эффективной вакцины против стригущего лишая не существует.
- Абсолютно надежного скринингового теста не существует
- Соблюдайте правила содержания — содержите животных в чистоте и хорошем питании, лечите другие болезни и от внешних и внутренних паразитов, всегда избегайте скопления людей и минимизируйте стресс
- Избегайте смешивания котят со взрослыми кошками
- Провести тщательный визуальный осмотр всех прибывающих животных и изолировать подозреваемых
- Дальнейший отбор кандидатов в приемные семьи и приемные семьи, как описано выше
- Во время вспышки болезни или в районах, где часто наблюдаются проблемы со стригущим лишаем, разделите всех котят в легко дезинфицируемом помещении не менее двух недель с последующим тщательным повторным осмотром на наличие признаков стригущего лишая
- Разработайте четкий письменный протокол обращения со стригущим лишаем и убедитесь, что персонал и приемные семьи знакомы с этим протоколом и признаками стригущего лишая.
Для получения дополнительной информации см. Серию веб-семинаров «Избавление от стригущего лишая» на ASPCApro.
100 мл Спрей для собак, кошек для лечения грибковых кожных заболеваний, микроспории и трихофитии
Описание
— эффективное средство для лечения грибковых заболеваний кожи у собак, кошек и мелких домашних животных.
Противогрибковый эффект наступает уже через 5 минут.
Состав — 100 мл:
Olamini piroctonas 1,0 г,
Полиоксиэтиленлауриловый спирт, пропиленгликоль,
глицерин 85%,
диметикон сополиол,
легкий денатурированный спирт.1% лек. бензин, вода дистиллированная.
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА:
Антибактериальное и противомикробное действие оказывает соединение пироктоноламин (октопирокс).
Серосодержащее вещество действует на дерматофиты рода Trichophyton и Microsporum, а также на T.mentagrophytes, T.rubrum, T.verrucosum, M. canis, M. gypseum.
Спрей нарушает метаболизм грибов и оказывает бактерицидное действие на Escherichia coli, Salmonella spp., Klebsiella spp., Enterobacteriacea spp. и синегнойная палочка.
Благодаря наличию вспомогательных компонентов препарат образует на коже защитную пленку и увлажняет ее.
Приемка:
Спрей применяется для лечения микроспории и трихофитии у собак, кошек и других пушных зверей.
ДОЗЫ И СПОСОБЫ ПРИМЕНЕНИЯ
Для эффективного использования продукта необходимо удалить загрязнения и шерсть животных внутри и вокруг пораженного участка.
Перед применением флакон с препаратом тщательно взболтать.
Распыление происходит в течение 2-3 секунд.
Расстояние до пораженной кожи 10-20 сантиметров.
Обработка поверхности необходима 4 раза в день с интервалом 2-4 дня.
Если выздоровления не произошло, курс лечения следует повторить.
Сроки курса назначает ветеринарный врач, они зависят от скорости заживления ран, а также от степени поражения кожных покровов.
Не следует предполагать, что во время лечения рядом с животным находилось открытое пламя или обогреватели.
Рекомендуется наносить препарат на открытом пространстве или в помещении должна быть хорошая вентиляция.
Необходимо предотвратить вылизывание препарата, для этого челюсти животного фиксируют намордником, тесьмой или специальным воротником на шее. Не допускайте попадания в глаза.
Если поражено более 25%, препарат наносят в два приема, сначала на одну половину тела, а затем на другую половину.
ПОБОЧНЫЕ ДЕЙСТВИЯ:
Возможность аллергических реакций у особо чувствительных животных.
10-кратная передозировка вызывает покраснение кожи и выпадение волос на обрабатываемой области.
Эти явления проходят через 5-7 дней, не требуя лечения.
ПРОТИВОПОКАЗАНИЯ:
Не допускается применение препарата продуктивным животным.
УСЛОВИЯ ХРАНЕНИЯ:
Препарат является горючим веществом 2 степени.
Хранить в закрытой таре производителя, отдельно от кормов и пищевых продуктов, в сухом, защищенном от света, недоступном для детей месте при температуре 0 — 25 ° C.
Грибковые инфекции | Vet-pythium.eu — ветеринарные препараты Clever Fungus Ecosin и Dermasin oil
Грибковые инфекции (стригущий лишай, дерматофития) — это клиническое заболевание, вызываемое несколькими различными видами дерматофитных грибов. Эти грибы питаются кератином (внешний слой кожи, волос и ногтей).Наиболее частыми возбудителями дерматофитии у собак и кошек являются Microsporum canis , который диагностируется при 77% дерматофитных инфекций, и Trichophyton mentagrophytes , диагностированный примерно у 24% собак и очень спорадически встречающийся у кошек. Этот дерматофит часто встречается у домашних и диких грызунов. Обычно он выглядит как красный, покрытый коркой шероховатый участок кожи со сломанными волосами и выпадением волос типичной круглой формы. Круглая форма — это типичный вид поражений, но эти поражения могут иметь неправильную форму.Состояние также может быть ошибочно принято за присутствие внешних паразитов, которые вызывают зуд, а также маскируются под вторичную бактериальную инфекцию с гнойными проявлениями. Когда это поражает когти животных, это может вызвать коробление, деформацию и сколы, что очень болезненно для животного и может привести к проблемам с ходьбой.
Заболевание передается не только инфицированными людьми, но и зараженными предметами вокруг животного, поэтому очень важно соблюдать строгие правила гигиены и использовать только собственное оборудование животного (ошейники, недоуздки, щетки и т. Д.)). Среди длинношерстных кошек приблизительно 89% являются бессимптомными носителями, поэтому у них нет симптомов, но у них все еще есть дерматофиты шерсти. Дерматофиты обычно проникают в кожу при травме или при ослаблении кожи, поскольку в здоровую кожу невозможно проникнуть. В отношении передачи несколько факторов влияют на то, инфицировано ли животное или нет, например, возраст животного, уровень иммунитета, а также беременность или кормление.